アクチン
「アクチンの多機能性の起源」
■背景
アクチンは分子量約42,000の中央がくぼんだ四角い座布団のような形をしたタンパク質で、可逆的に重合して二重らせん状のアクチン繊維を形成する。この重合現象が、一次元的な結晶成長と同じだと看破したのは、本学会の大先輩の偉業である[1]。
さてアクチンはもともと、筋収縮に必要なタンパク質として発見された[2]が、その後、高等動植物からカビや酵母などの菌類に至るすべての真核細胞に含まれ、細胞運動・細胞質分裂、細胞の形態や細胞膜構造の維持、細胞内輸送、形態形成、貪食、さらには細胞核内構造の維持や転写制御などきわめて多様な現象で中心的な役割を果たしていることが判明した。こうしたそれぞれのアクチン機能は、特定のアクチン結合タンパク質との相互作用に基づくと考えられている。他方、アクチンのアミノ酸配列は極端に保守的で、酵母アクチンとヒト細胞質βアクチンは90%相同である。さらに、酵母やマウスは一種類の細胞質アクチンで十分生育できることが分かっており、酵母からほ乳類細胞に至るまで非常によく似たタンパク質が実質的に一種類だけ発現されていることになる(筋肉アクチンや高等植物アクチンは、多少状況が異なる可能性がある)。しかし、ほぼ同じタンパク質がきわめて多様な機能を果たすということは、考えてみると不思議なことである。さらにいうと、化学的に同一の別々のアクチン繊維が、同一細胞内の異なる場所で同時に異なるアクチン結合タンパク質と相互作用して異なる機能を果たしていることになるが、これは一体、どのような分子的基盤によるのだろうか?
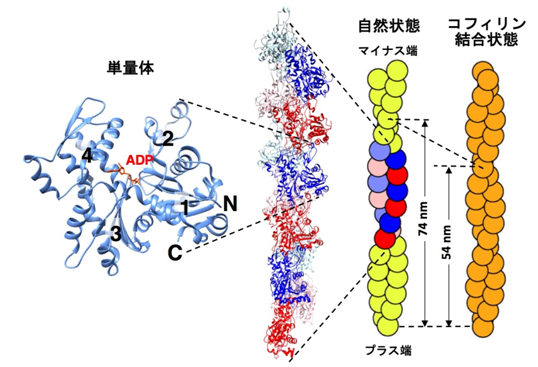
図1.アクチン単量体の構造(左;PDB code: 1J6Z)と、アクチン繊維のモデル(中央、PDB code 3G37)、および模式図(右)。単量体は、繊維中で同じ向きに並んでいる。そのため、繊維には極性があり、両端も異なっている(重合速度が速い方の端をプラス端、遅い方の端をマイナス端とよぶ)。右端はコフィリンが結合した状態のアクチン繊維のモデル(コフィリンは示していない)で、らせんピッチが74 nmから54 nmに短くなっている。
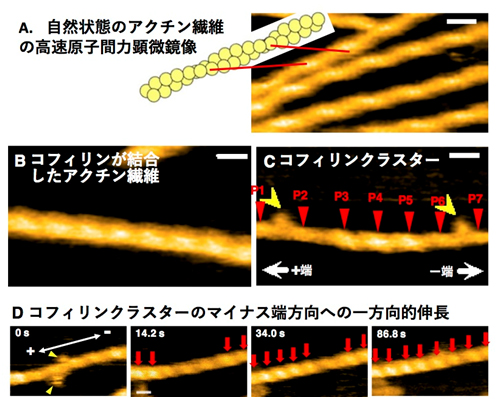
図2.高速AFMを用いた、アクチン繊維の協同的構造変化のリアルタイム観察。A:自然状態のアクチン繊維。AFMは、平坦な基板上の物体の高低を可視化する顕微鏡で、個々のアクチン分子が二重らせん構造を構成する様子が見て取れる。アクチン繊維の2本のプロトフィラメントが縦に重なったところ(クロスオーバー点とよぶ)は背が高く、AFM像では明るい色で表示されている(赤線で対応関係を示した)。クロスオーバー点の間隔が半らせんピッチとなる。B:コフィリンで覆われたアクチン繊維。コフィリン分子の分だけフィラメントが太くなり、また半らせんピッチが短くなっていることが分かる。C:コフィリンが短いクラスターを形成したアクチン繊維。過渡的に結合するミオシンのモータードメイン(S1とよぶ;黄矢頭)の結合角から、右がマイナス端方向と判断できる。コフィリンクラスター内(P3, P4, P5の間)の半らせんピッチが短いことはBと同様だが、マイナス端側に隣接する裸の領域(P5とP6の間)の半らせんピッチも短い。逆にプラス端側に隣接する裸の領域(P2とP3の間)の半らせんピッチは自然状態と同じであることから、コフィリンクラスターで生じた構造変化がマイナス端方向のみに協同的に伝播したことが分かる。D:コフィリンクラスターの成長。このアクチン繊維も右方向がマイナス端方向である。14.2秒時点ではコフィリンクラスター(クロスオーバー点を赤矢印で示した領域)が二つあり、左側のクラスターは右方向に伸長したが、右側のクラスターは左方向に伸長しなかった。スケールバー:25 nm。文献[3]より改変転載。
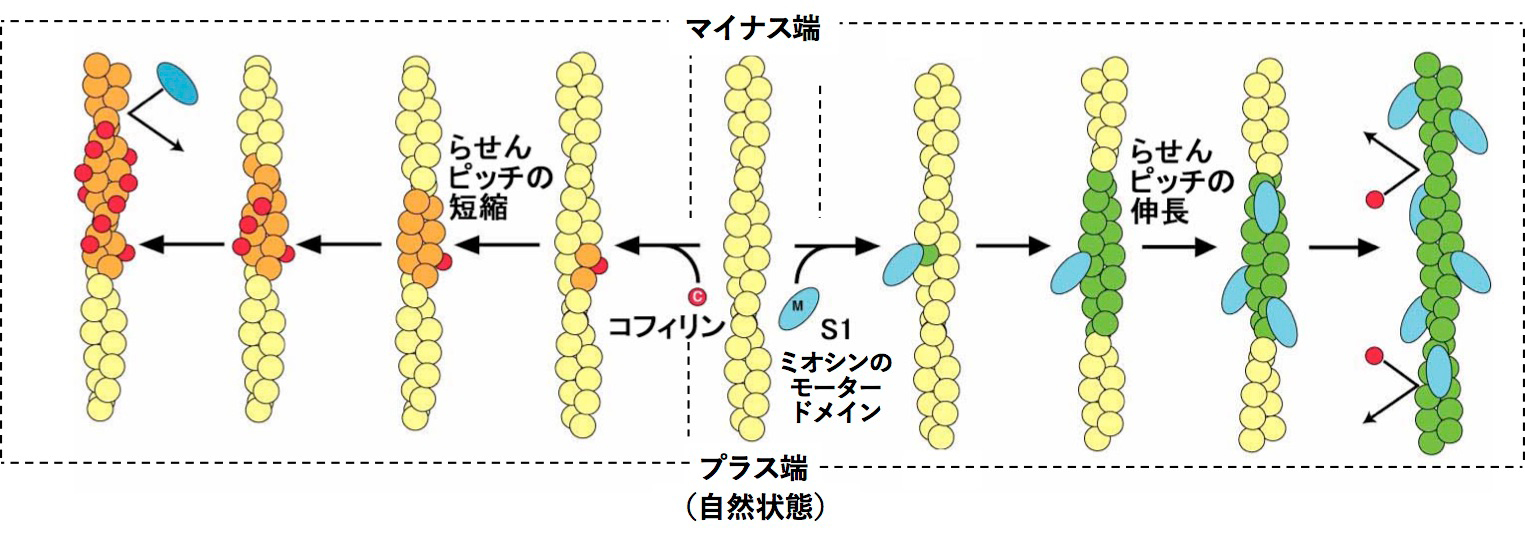
図3.アクチン繊維の協同的構造変化のモデル。
左:図2でも示したとおり、アクチン繊維にコフィリン(赤丸)が結合するとらせんピッチの短縮を伴う構造変化がおき(橙色)、この構造変化は、マイナス端側のコフィリンが結合していない領域に伝播する(協同的構造変化の一方向的な伝播)。コフィリンは短らせんピッチのアクチン繊維と親和性が高い[4]ので、こうした領域にコフィリンが結合し、コフィリンのクラスターはマイナス端方向に一方向的に伸長する[3]。逆に、こうした繊維にはS1(青の楕円)は結合しにくい[5]。
右:一方ATP存在下のS1は、コフィリンとは異なる構造変化をアクチン繊維に誘起する(緑)。こうしたアクチン繊維にはS1が一過的かつ協同的にまばらに結合し、コフィリンの結合は強く阻害される[5]。
■研究概要
アクチン繊維は結晶化が難しいので、結晶構造解析より分解能が劣るクライオ電子顕微鏡解析(急速凍結した標品の高解像度電子顕微鏡観察と画像解析の組み合わせ)による構造解析が主となっている[6]。その結果、ある種のアクチン結合タンパク質がアクチン繊維に結合すると、アクチン繊維の構造が変化することが分かってきた(構造多型性とよぶ)。
もっとも良く解析されている構造多型性は、コフィリン(アクチン繊維に結合して、これを切断し、最終的に脱重合を引き起こす)というタンパク質が結合した場合である。少量のコフィリンとアクチン繊維を混合すると、コフィリンはアクチン繊維にそってまばらに結合するのではなく、一部分に固まって結合し「クラスター」を形成する(協同的結合とよぶ)のだが、そのコフィリンクラスター内のアクチン繊維のらせんピッチが、25%短縮することが示されていた(図1右、[7, 8])。そこでわれわれは、高速原子間力顕微鏡 を用いて、コフィリンクラスターの形成・成長過程をリアルタイムで観察した。その結果、コフィリンクラスター内部のらせんピッチが短縮した構造が、隣接するコフィリンの結合していない領域まで伝播すること、さらにこの伝播が繊維のマイナス端方向には伝播するが、プラス端方向には伝播しないこと(一方向的な協同的構造変化の伝播)ことを発見した(図2)。またこれに伴い、コフィリンクラスターは、繊維のマイナス端方向に一方向的に伸長することも発見し、アクチン繊維の構造多型性の高機能性が示唆された[3]。
さてアクチン結合タンパク質としてもっとも有名なのは、ATPに依存してアクチン繊維を動かす分子モーター、ミオシンであろう。ミオシンの結合も、アクチン繊維の構造を協同的に変化させることが知られている[9]が、技術的な困難もあり、具体的にどのように構造が変化するのかよく分かっていない。しかしわれわれは、高速原子間力顕微鏡および全反射蛍光顕微鏡観察により、ATP存在下でミオシンとアクチン繊維が相互作用すると、コフィリンの結合が強く阻害されることを見出した[5]。アクチン繊維を構成するアクチン分子のうち、ほんのごく一部(10%以下)がミオシンと相互作用している条件下でもコフィリン結合は強く阻害されるので、一分子のミオシン結合が10分子以上のアクチン分子の構造を変化させること、すなわち強い協同性をもつことも明らかとなった。
以上の結果などから、コフィリンとミオシンはそれぞれアクチン繊維に異なった協同的構造変化を引き起こし、ミオシンによる協同的構造変化はコフィリン結合を阻害すること、逆に、コフィリンによる協同的構造変化はミオシン結合を阻害することが示され、図3にまとめたようなモデルを提唱している。なお、コフィリンやミオシン以外にも多数のアクチン結合タンパク質が知られており、それらの多くもアクチン繊維に協同的な構造変化を引き起こすことが示されていたり、示唆されているので、図3に示したスキームはより大きな全体像のごく一部である可能性が高いと考えている。
■科学的・社会的意義
アクチン繊維はヒトを含む真核細胞の中でもっとも重要なタンパク質の一つといって過言ではなく、その機能メカニズムを解明することには、大きな意義がある。また原核生物(バクテリアと古細菌)もアクチンをもつが、原核アクチンは真核アクチンと異なり、配列の多様性が高く、単機能である。すなわち、多様で単機能のアクチンから均一で多機能のアクチンが進化したと考えられるが、真核細胞がもつ高度な機能性の多くはアクチンの多機能性と関連するので、真核生物の出現に際して均一で多機能の真核アクチンがどのように確立したのかは、進化論的にも興味深い問題である。
■参考文献
1. Kasai M, Asakura S, Oosawa F. The G-F equilibrium in actin solutions under various conditions. Biochim Biophys Acta. 1962;57:13-21. doi.org/10.1016/0006-3002(62)91072-7
2. Straub FB. Actin. Studies from the Institute of Medical Chemistry University Szeged. 1942;2:3-15.
3. Ngo KX, Kodera N, Katayama E, Ando T, Uyeda TQP. Cofilin-induced unidirectional cooperative conformational changes in actin filaments revealed by high-speed atomic force microscopy. Elife. 2015;4. doi: 10.7554/eLife.04806.
4. Galkin VE, Orlova A, Lukoyanova N, Wriggers W, Egelman EH. Actin depolymerizing factor stabilizes an existing state of F-actin and can change the tilt of F-actin subunits. J Cell Biol. 2001;153:75-86. doi: 10.1083/jcb.153.1.75.
5. Ngo KX, Umeki N, Kijima ST, Kodera N, Ueno H, Furutani-Umezu N, et al. Allosteric regulation by cooperative conformational changes of actin filaments drives mutually exclusive binding with cofilin and myosin. Sci Rep. 2016;6:35449. doi: 10.1038/srep35449.
6. Fujii T, Iwane AH, Yanagida T, Namba K. Direct visualization of secondary structures of F-actin by electron cryomicroscopy. Nature. 2010;467:724-8. doi:10.1038/nature09372.
7. McGough A, Pope B, Chiu W, Weeds A. Cofilin changes the twist of F-actin: implications for actin filament dynamics and cellular function. J Cell Biol. 1997;138:771-81. doi: 10.1083/jcb.138.4.771.
8. Galkin VE, Orlova A, Kudryashov DS, Solodukhin A, Reisler E, Schroder GF, et al. Remodeling of actin filaments by ADF/cofilin proteins. Proc Natl Acad Sci USA. 2011;108:20568-72. doi: 10.1073/pnas.1110109108.
9. Oosawa F, Fujime S, Ishiwata S, Mihashi K. Dynamic properties of F-actin and thin filament. Cold Spring Harbor Symp Quant Biol. 1973;37:277-85. doi: 10.1101/SQB.1973.037.01.038.
■良く使用する材料・機器
1) 高速原子間力顕微鏡
2) 全反射蛍光顕微鏡
 H29年度分野別専門委員
H29年度分野別専門委員
早稲田大学・理工学術院
上田太郎(うえだたろう)
URL: https://www.qp.phys.waseda.ac.jp/index.html










