単一分子分光
「平均化の呪縛を解き、乱雑さの中から生体系の機能原理を見出す」
■背景
スマートフォンは安定して動作します。あるアプリを起動すればいつも同じものが起動し、たまに全く違うやつが起動しちゃうよね、といったことはありません。これは半導体や電子回路など、無機物ベースで構成されるシステムがエラーを起こさず規則正しく機能してくれているからに他なりません。一方、生物の体は有機物をベースに構築されています。見るからに硬くて構造が安定していそうな無機固体とは異なり、生体系を構成するタンパク質や脂質膜などは構造に大きな自由度があり、一見すると不安定極まりないシステムに思われます。しかしながら、我々の体を見ても分かるように、生体系も秩序を保ちつつ非常に安定に機能しています。もう少しちゃんと言うと、生体内のように不均一かつ動的な環境において、ミクロな領域では非平衡な状態しか存在せず、常に乱雑な摂動に曝されながら多種多様な物理化学過程が進行しています。それにも関わらず、一連の反応が方向性を維持しながら巧妙に連関することでシステム全体として安定に機能します。このような乱雑さの中に埋もれた情報を抜き出し、生体機能を解析する手法として単一分子分光法が発展してきました。(単一分子分光とはその名の通り1粒の分子を分光解析する手法ですが、ここで言う“分子”というのは化学で習うような分子だけではなく、タンパク質粒子なども含んだ広義の意味であり、単一タンパク質分光や単一粒子分光などと呼ばれたりもします。)
地球上の生物は太陽からの光エネルギーに支えられており、光を有効活用するために種々の色素や光受容タンパク質を進化させてきました。これらを抽出して単一分子レベルで観測すると僅かながらに構造が熱的に揺らいでいます。この微小な構造変化が光反応機能にどう影響するのかを調べるために分光法の力を借ります。分光法を用いれば反応系の状態や過渡的な時間変化を詳細に調べることができます。単一分子分光では信号-ノイズ比に優れる蛍光検出が主に用いられ、蛍光の強度・寿命・偏光・スペクトルなどの経時変化から光反応系で生じる揺らぎを観測します。ここで、時間的に変動する信号はそれぞれが異なる構造状態を反映しています。そのため、1つ1つの構造状態と光反応の速度・効率・経路などを1対1で対応させて統計的に解析できます(図1A)。ここで強調したいのは、通常の分光測定では ~1010個に及ぶ大量の粒子をまとめて観測するので(これをアンサンブル測定と呼びます)、このような統計情報は平均化されて解析できない、という点です(図1B)。この平均化の呪縛を解くことができるのが、単一分子分光の最大の強みと言えます。
では、なぜ平均化が問題となるのでしょうか?例えば、通常のアンサンブル測定で平均的な構造と反応速度を定量した場合、当たり前ですが、その構造でそのような速度の反応が生じていると解釈します。しかし、もしかすると、とんでもなく低い確率でしか存在し得ないが、尋常ではないくらい高速で反応が進行する特別な構造状態があるかもしれません(図1A)。構造揺らぎを介してこのようなレアな構造状態を探索し、系全体が上手く機能していることも十分あり得ます。このような場合、アンサンブル測定で得られる平均的な構造情報や反応速度は、生体系の機能原理を理解する上であまり重要ではありません。つまり、これまでの構造と機能の相関という考え方をより拡張させた、構造ダイナミクスと機能の相関という新たな視点が必要になってきます。単一分子分光はこのような平均化に埋もれてしまった未開拓領域に切り込むための強力な武器となります。
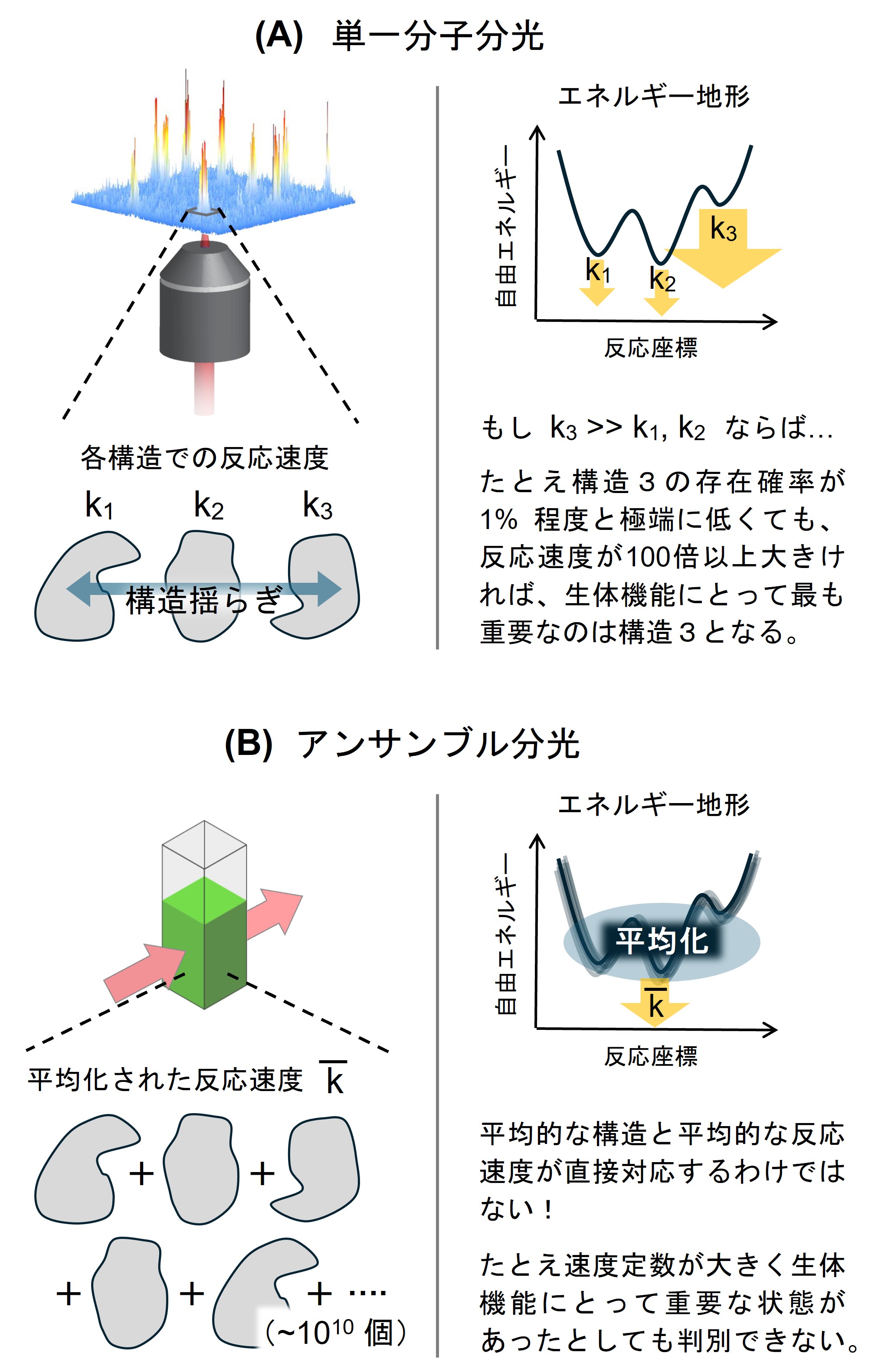
図1 (A) 単一分子分光と (B) 通常のアンサンブル分光の比較。単一分子分光を用いれば1つ1つの構造状態とそこで生じる反応の速度・効率・経路などを1対1で対応させて統計的に解析できる。
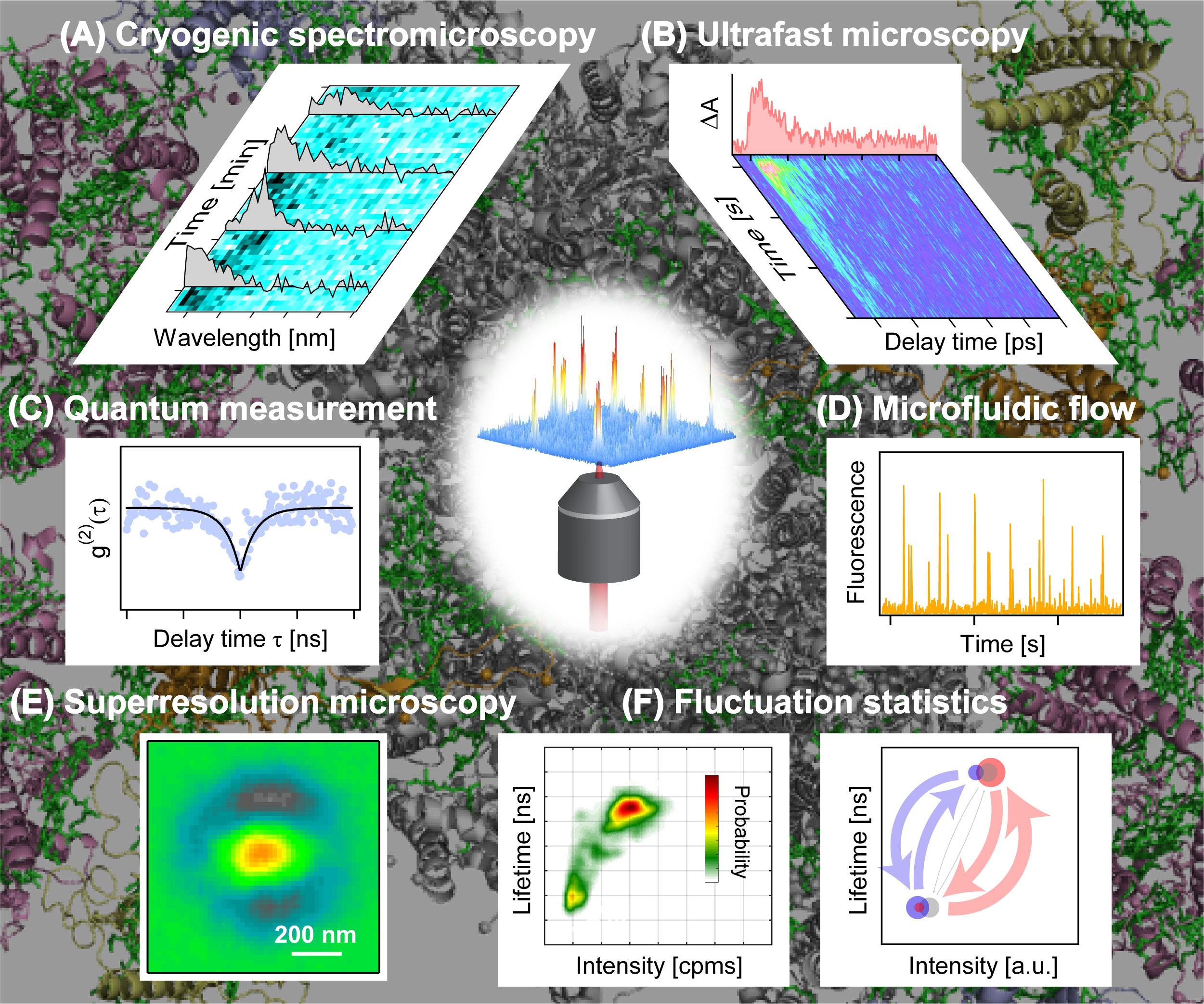
図2 これまでに開発した種々の単一分子分光法。 (A) 極低温分光顕微鏡で観測した蛍光スペクトルの揺らぎ(文献4)。 (B) フェムト秒過渡吸収顕微鏡で観測した光合成光エネルギー移動。 (C) 量子計測顕微鏡で観測したアンチバンチング信号。 (D) 単一分子マイクロ流路フロー分光顕微鏡で観測したマイクロ流路を流れる粒子のスパイク信号。 (E) 超解像顕微鏡で観測した単一粒子イメージ。 (F) 蛍光の強度と寿命の時間的な揺らぎを同時に観測することで得られる統計データの解析結果。左図は蛍光強度を基に解析した結果で、構造状態の分布と存在確率を可視化できる(文献1)。右図は蛍光寿命を基に解析した結果で、構造揺らぎの成分数・速度定数・自由エネルギー差を定量化できる(文献2)。
■研究概要
太陽から降り注ぐ光エネルギーは膨大であり、地球表面への照射量だけでも 1017 W に及びます。このような巨大な光エネルギーを最も巧みに利用するのが光合成生物であり、年間1000 億トンもの糖類及び 2600 億トンもの酸素を生み出し、地球上の生命活動を根底から支えています。巨大な化学プラントを使っても到底真似できないエネルギー・物質変換を実現しているわけですが、反応場となるのはナノメートルサイズの非常に小さなタンパク質です。背景の項でも述べた通り、タンパク質の構造は熱的に揺らいでおり、光合成光反応にとっても何か重要な役割があるかもしれない、と素朴に考えました。そこで、単一分子分光を用いて解析を進めてきました。
単一分子からの信号は非常に微弱なため、測定には高感度な光学顕微鏡が必要です。各種メーカーの既製品やカスタム品を利用することも可能ですが、真に解析したい分光データを取得するためには、種々の分光技術を取り込んだオリジナルの装置を開発することが重要となります(図2)。例えば、蛍光の強度と寿命の揺らぎを同時に観測できる単一分子蛍光顕微鏡を構築し、環境のpH変化に応じてタンパク質の構造揺らぎ特性を調整する光合成活性の制御機構を明らかにしました(図2F左、文献1)。統計解析手法を工夫すれば、揺らぎ特性を指標にタンパク質の構造変化を調べることができます(図2F右、文献2)。さらに、極低温分光顕微鏡を用い、低温下で構造揺らぎの速度を遅くして詳細にスペクトル解析を行うことで、局所的な構造揺らぎが光捕集機能に大きく寄与することも突き止めました(図2A、文献3, 4)。単一分子分光にとって大きな課題となっている超高速時間分解測定を実現するため、フェムト秒レーザーを用いて励起状態ダイナミクスの時間変化を観測できる蛍光検出型の時間分解顕微鏡も開発しました(文献5)。
さらに最近は、生体系で生じる電子移動や酸化還元反応などの非蛍光性過程の単一分子観測に向け、高感度過渡吸収顕微鏡の開発を進めています(図2B)。また、生体光反応に関わる励起子状態の単一粒子解析に向けた量子計測顕微鏡(図2C)、空間的に密集したタンパク質の単一粒子分光を目指した超解像顕微鏡(図2E)、pH変化や熱ショックなどの環境因子でトリガーされるタンパク質の応答機構を調べるための単一分子マイクロ流路フロー分光顕微鏡など(図2D)、様々な単一分子分光技術を開発しています。これまでの平均化された情報からは知り得なかった未知の領域を開拓すべく研究を進めています。
■科学的・社会的意義 世界に1つだけのオリジナル装置を作り、これまで誰も観測できなかった摩訶不思議な生体現象を観察し、物理学・化学・生物学・数学などの広範な知識を総動員して解析・解釈し、真に興味深い知見が得られれば、新たな科学の潮流を日本から生み出すことができます。こんなに楽しいことはなく、研究者冥利に尽きること間違いなしです。
■参考文献
1)Kondo T., Pinnola A., Chen W.J., Dall'Osto L., Bassi R., and Schlau-Cohen G.S., ”Single-molecule spectroscopy of LHCSR1 protein dynamics identifies two distinct states responsible for multi-timescale photosynthetic photoprotection”, Nat. Chem. 9, 772−778 (2017).
2)Kondo T., Gordon J.B., Pinnola A., Dall'Osto L., Bassi R., and Schlau-Cohen G.S., “Microsecond and millisecond dynamics in the photosynthetic protein LHCSR1 observed by single -molecule correlation spectroscopy”, Proc. Natl. Acad. Sci. USA 116, 11247−11252 (2019).
3)Kondo T., Mutoh R., Tabe H., Kurisu G., Oh-Oka H., Fujiyoshi S., and Matsushita M., “Cryogenic single-molecule spectroscopy of the primary electron acceptor in the photosynthetic reaction center”, J. Phys. Chem. Lett. 11, 3980–3986 (2020).
4)Kondo T., Mutoh R., Arai S., Kurisu G., Oh-Oka H., Fujiyoshi S., and Matsushita M., “Energy transfer fluctuation observed by single-molecule spectroscopy of red-shifted bacteriochlorophyll in the homodimeric photosynthetic reaction center”, J. Chem. Phys. 156, 105102 (2022).
5)Moya R., Kondo T., Norris A.C., and Schlau-Cohen G.S., “Spectrally-tunable femtosecond single-molecule pump-probe spectroscopy”, Opt. Express 29, 28246−28256 (2021).
■良く使用する材料・機器
1)フェムト秒パルスレーザー Synergy PRO(Spectra Physics)
2)ピエゾステージ Nano-LP100(Mad City Labs)
3)レンズやミラーなどの各種光学素子(Thorlabs、Newport、シグマ光機)
4)対物レンズ(エビデント、ニコン)
5)各種電動ステージ(駿河精機)
2024年分野別専門委員
自然科学研究機構 基礎生物学研究所・生命創成探究センター
近藤 徹 (こんどう とおる)
https://tklabtitech.wixsite.com/tk-lab
