顕微鏡プローブ
「細胞内の分子濃度や酵素活性を可視化する」
■背景
光学顕微鏡は生体組織や細胞、細胞内の構造などを詳細に観察するための重要な研究ツールであり、近年その技術は目覚ましい勢いで発展しています。しかし、現代の高性能な光学顕微鏡を使っても、分子量の小さな代謝物や酵素活性のようなものを直接観察することはできません。しかし、これらを特異的に検知するようなプローブ分子を細胞に導入し、光学顕微鏡でそのプローブからの信号を捉えることで、生きた細胞内における低分子の濃度や酵素活性等を間接的に計測することが可能です。
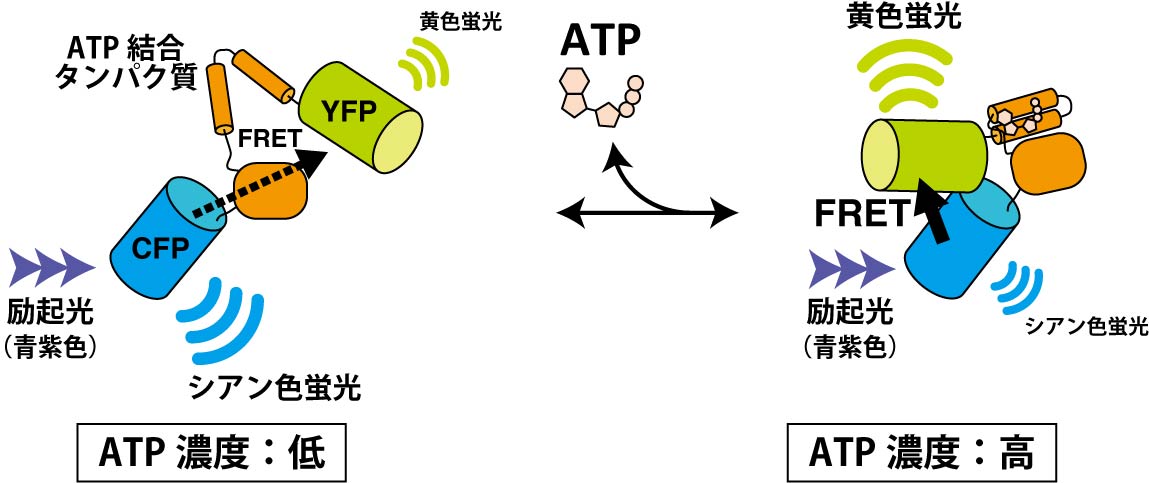
図1 ATP濃度を検出する蛍光プローブのしくみ。ATP濃度が高くなるとATP結合タンパク質はATPを結合して閉じた構造へと移行する。その結果、CFPからYFPへのFRET効率が増大する。
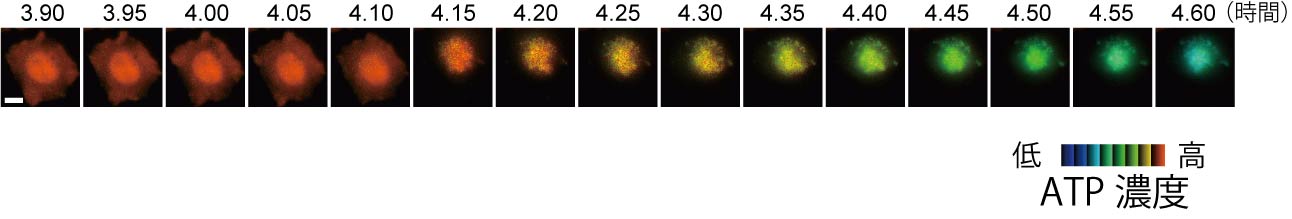
図2 アポトーシスで細胞が死ぬ過程の細胞内ATP濃度変化。蛍光ATPプローブのFRET効率を擬似カラーで示している。
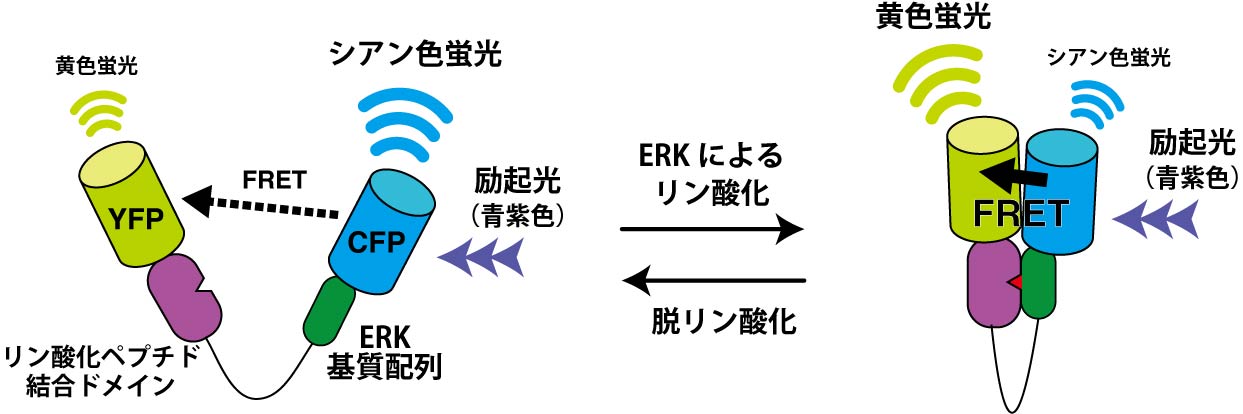
図3 タンパク質キナーゼERKの活性を検出する蛍光プローブのしくみ。ERKによってプローブ内の基質配列がリン酸化されると、CFPからYFPへのFRET効率が上昇する
■研究概要
プローブ分子には様々な種類がありますが、ここではフェルスター共鳴エネルギー移動(FRET)と呼ばれる、励起状態の蛍光分子のエネルギーが近くにある蛍光分子に移動する現象を利用した蛍光性のプローブ分子について、2つの例を紹介します。
[例1:ATP濃度を検出する蛍光プローブ]
ATP(アデノシン三リン酸)は細胞のエネルギー運搬体であり、様々なタンパク質の仕事に使われるエネルギーを供給することで、細胞の活動を支えています。ある種のバクテリアには、ATP低濃度ではATPを結合できずに開いた立体構造をとり、ATP高濃度ではATPを結合して閉じた立体構造になるタンパク質があります。このATP結合タンパク質の両端にシアン色の蛍光タンパク質(CFP)と黄色の蛍光タンパク質(YFP)を融合させると、ATPの濃度に応答してCFPとYFPの距離が縮まったり離れたりします。両者の距離が縮まるとFRETが生じ、CFPが光る前にそのエネルギーがYFPに移動してYFPが光るようになります。一方、両者が十分に離れているとFRETはほとんど生じません。そのため、ATP濃度が高いとYFPの黄色の蛍光が強くなり、逆にATP濃度が低くなるとCFPのシアン色の蛍光が強くなります(図1、文献1)。すなわち、この融合タンパク質は、蛍光の色を調べることでATPの濃度を知ることができる蛍光ATPプローブということになります。この蛍光ATPプローブをコードする遺伝子を細胞の中に導入すれば細胞の中で蛍光ATPプローブが作られるので、この細胞を蛍光顕微鏡でイメージングすることで、個々の細胞の中のATP濃度の分布や時間変化を計測できるわけです。図2はアポトーシス細胞死を誘導した際の細胞内ATP濃度の変化を観察したものです(文献2)。アポトーシス細胞のATP濃度が、ある時点を境にして急激に減少していることがわかると思います。
[例2:タンパク質キナーゼの活性を検出する蛍光プローブ]
細胞の中には非常に多くの種類の酵素が存在し、それぞれが細胞の活動に必要な化学反応を担っています。基質となるタンパク質をリン酸化するタンパク質キナーゼは、細胞内の情報伝達に重要な役割を担う酵素です。例えば、古典的MAPキナーゼとして知られるERKは、上皮成長因子などから入力刺激が入ると活性化され、転写因子を含む基質タンパク質のセリンやスレオニンをリン酸化することで、細胞の運動や増殖を制御します。ERK活性を検出する蛍光プローブは、ERKの基質となるペプチド配列と、リン酸化ペプチドに結合するタンパク質、そしてCFPとYFPを組み合わせることで開発されました(文献3)。基質ペプチド配列内のスレオニンがERKによってリン酸化されると、そこにリン酸化ペプチド結合タンパク質が結合し、その結果CFPとYFPの距離が縮まりFRETが生じるという仕掛けです(図3)。ERKプローブを導入した細胞をイメージングすることで、細胞集団が移動する際にERKの活性が、進行方向とは逆方向の隣接する細胞へ伝搬していくことなどが明らかにされています(文献4)。
狙った性能を持つ蛍光プローブを開発することは必ずしも簡単ではありません。しかし、性能の良いプローブを作ることができれば、物質の濃度や酵素の活性等を高い時間・空間分解能で計測するという、他の手法では難しい計測を実現することができます。近年は蛍光だけでなく生物発光を利用したプローブの開発も活発におこなわれています。
■科学的・社会的意義 同一のゲノムを持った細胞を同一の条件に置いた場合であっても、遺伝子発現量や、代謝物濃度、薬剤感受性などに個々の細胞でばらつきがあることが、近年の研究でわかってきています。多数の細胞からの抽出液を用いた解析では、細胞間のばらつきや時間的なゆらぎが平均化されてしまいますし、細胞集団の中の少数の細胞だけが示すような現象を検出することは極めて困難です。蛍光プローブと光学顕微鏡を用いた解析法は、単一細胞ごとの計測が可能であり、細胞の回収や破砕といった操作ステップを挟まないために再現性の良い結果が得られやすいなど、細胞の正確な性質やふるまいを理解するための強力な手法です。こうした特徴のため、基礎科学分野だけでなく、創薬スクリーニングや化合物の活性や毒性等の評価への応用も期待されています。
■参考文献
1)Imamura, H., K.P. Huynh Nhat, et al. (2009). "Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators." Proc Natl Acad Sci USA 106(37): 15651-15656.
2)Imamura, H., S. Sakamoto, et al. (2020). "Single-cell dynamics of pannexin-1-facilitated programmed ATP loss during apoptosis." eLife 9: e61960.
3)Harvey, C.D., A.G. Ehrhardt, et al. (2008). "A genetically encoded fluorescent sensor of ERK activity." Proc Natl Acad Sci USA 105(49): 19264-19269.
4)Hino, N., L. Rossetti, et al. (2020). "ERK-mediated mechanochemical waves direct collective cell polarization." Dev Cell 53 (6): 646-660.
■良く使用する材料・機器
1) 蛍光顕微鏡システム Ti-E (株式会社ニコン)
2) 蛍光分光光度計 FP-8300 (日本分光株式会社)
3) sCMOSカメラ Zyla4.2 (オックスフォード・インストゥルメンツ株式会社)
 2024年分野別専門委員
2024年分野別専門委員
京都大学・生命科学研究科
今村博臣 (いまむらひろみ)
https://sites.google.com/kyoto-u.ac.jp/hiromi-imamura
