走性
「バクテリア1細胞内のタンパク質の動態から細胞の走性行動を理解する」
■背景
走性とは生物が周囲の化学物質等の濃度勾配に対して方向性を持った行動を起こす現象のことで、生物はこの走性により生育に適した環境を求めて移動します。走性は細菌(バクテリア)やゾウリムシなどの単細胞生物にも備わった原始的な生命システムの一つです。私たちの研究グループでは、大腸菌などのバクテリアの走性を研究対象としています。大腸菌は分子生物学の発展に大きく寄与し、他種生物の遺伝子改変などにも利用される生物ですが、そのような大腸菌も、自分にとって適した環境へ移動する走性を示します。もちろんバクテリアには「脳」はありません。しかしバクテリアは“たった一つの細胞”で環境をモニター・判断して運動装置のべん毛をコントロールし、直進遊泳と遊泳方向の転換の頻度を巧みに変化させて、自分の好みの環境へ移動していきます。この情報処理システムは『走化性システム』と呼ばれ、細胞内のタンパク質によって実行されています(図1)。私たちは、このシステムに関わるタンパク質の機能だけでなく、バクテリア1細胞内のタンパク質のどの様な動態の変化が、どの様な細胞の行動を引き起こすのかについて定量的な観点(数、濃度、局在などの変化)から解き明かしたいと考えています。
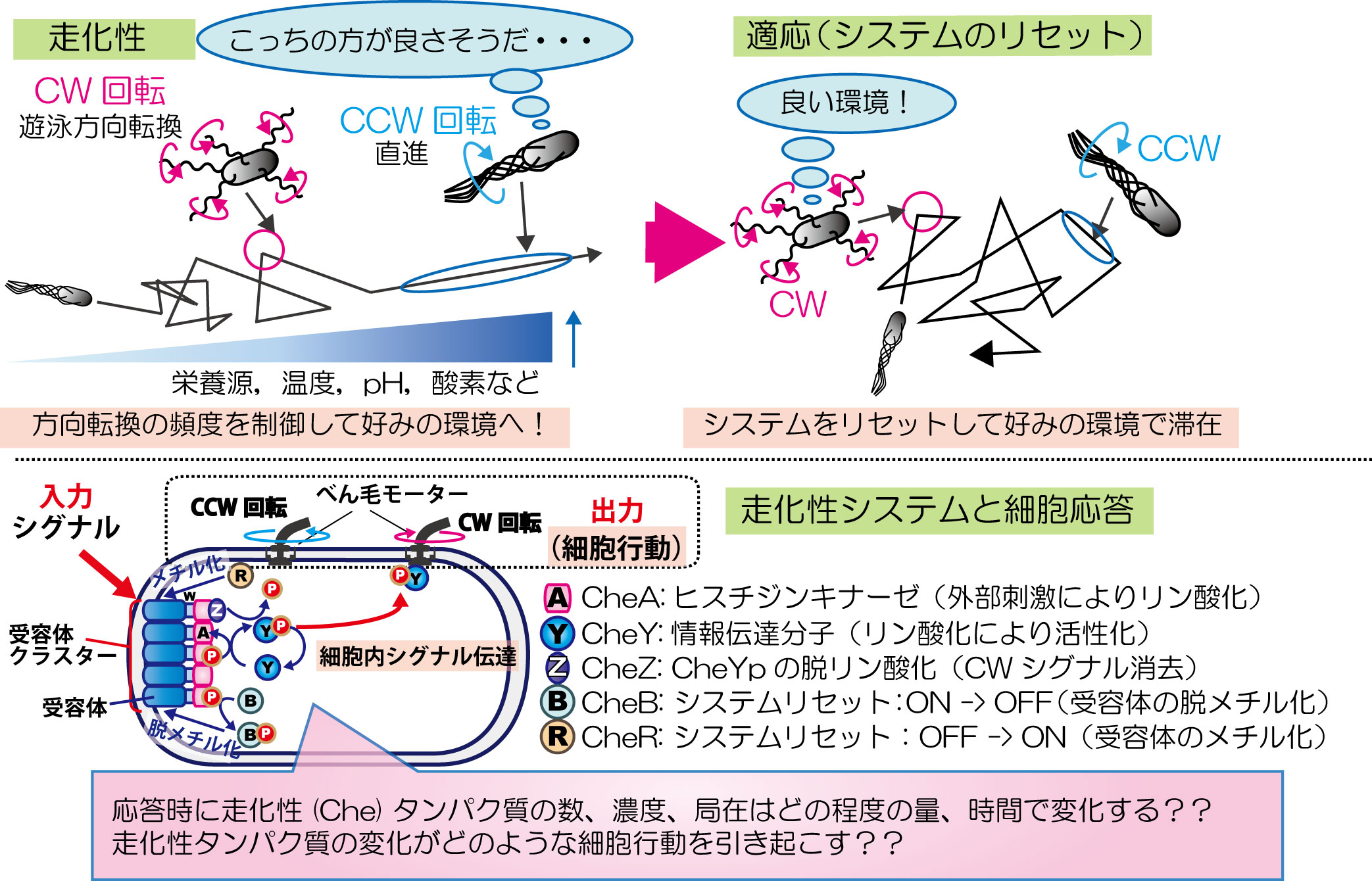
図1 大腸菌の走化性と走化性システム。大腸菌は周囲の環境を認識して自身に適した環境へ移動する。『走化性システム』は感知した細胞外シグナル(入力)をべん毛モーターの回転方向に変換し、細胞行動(出力)をコントロールする。
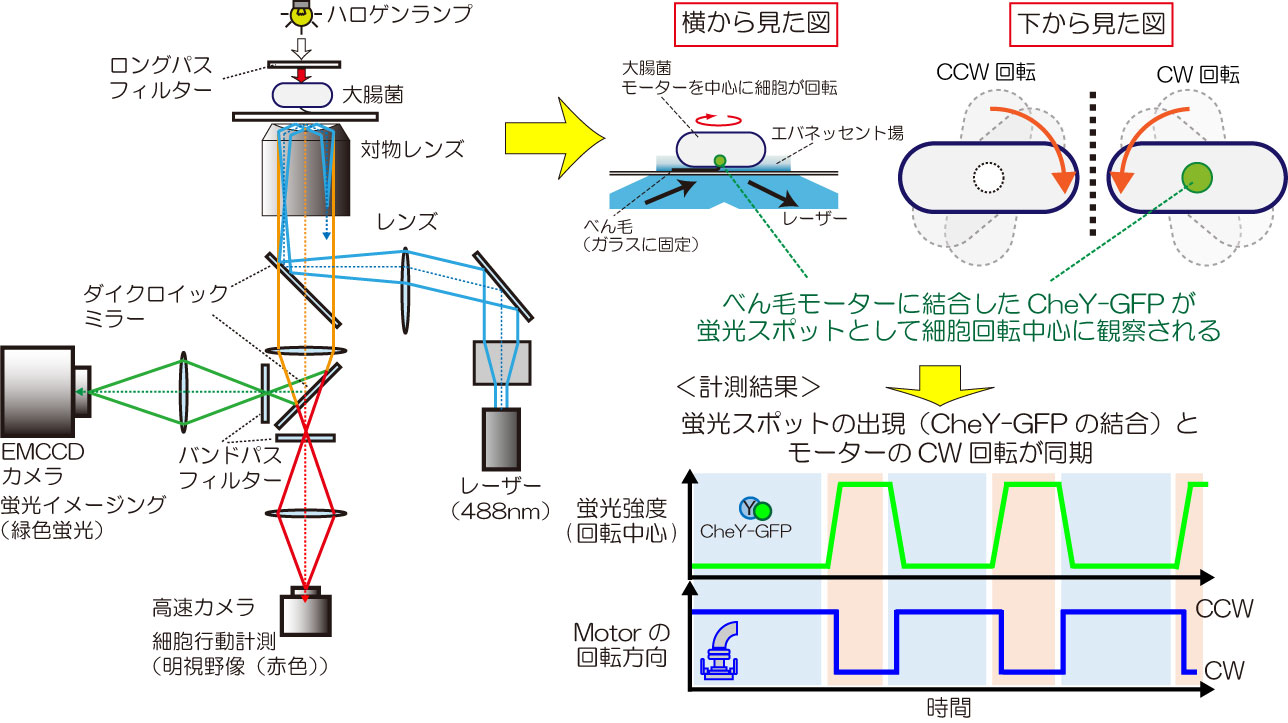
図2 蛍光像と明視野像を同時に観察する顕微鏡システム。細胞内情報伝達タンパク質動態(例:情報伝達タンパク質CheY)と大腸菌の行動(例:べん毛モーター回転)の同時計測が可能。
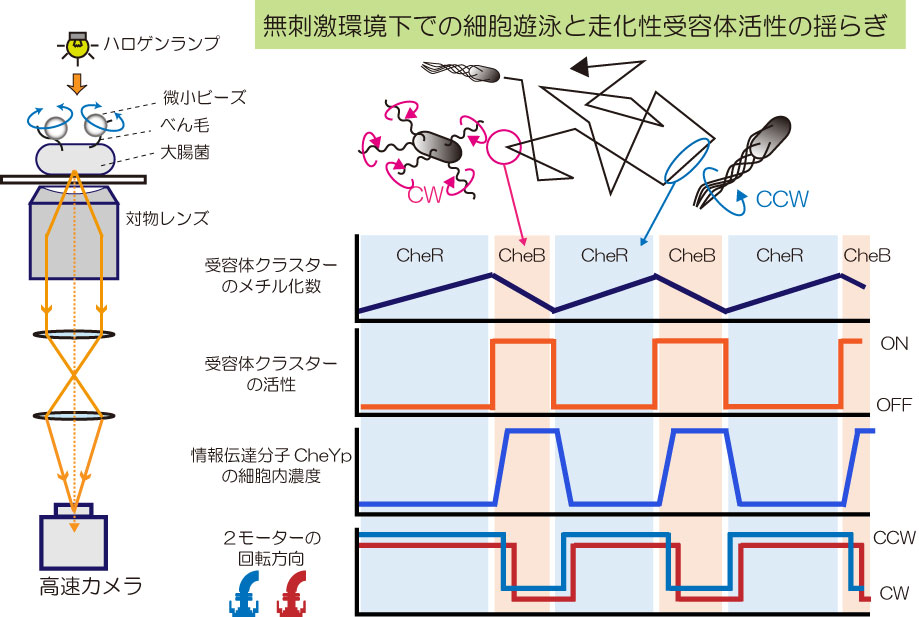
図3 定常状態における受容体クラスター活性の自発的活性化に伴う大腸菌べん毛モーター回転方向の同調制御。モーター間の同調制御が起因となり、無刺激環境下における細胞遊泳(直線遊泳と方向転換)がコントロールされる。
■研究概要
私たちは光学顕微鏡を基盤として、細胞行動の高時間分解能計測や、蛍光イメージング法による細胞内のタンパク質の動態観察を行っています。またこれらの計測を『同じ細胞で』かつ『同時に』行うこことで、細胞内の走化性タンパク質のどのような動態変化が、どのような細胞行動を引き起こすのかを調べています(図2)。
受容体によるシグナル受容は、ヒスチジンキナーゼCheAの自己リン酸化を促し、リン酸基は情報伝達タンパク質CheYに転移されます。従来からリン酸化CheYがべん毛モーターに結合するとモーターが反時計回転から時計回転へと転換すると考えられていましたが、実際に回転するモーターで実証されたわけではありませんでした。私たちは緑色蛍光タンパク質(GFP)とCheYの融合タンパク質(CheY-GFP)とモーターの回転方向転換を同時に観察することで、モーターの回転方向転換がリン酸化CheYの結合・解離で直接制御されることを実証しました(図2、文献1)。
また,べん毛繊維に付着させた微小ビーズによりべん毛モーターの回転を高速カメラで計測しました。刺激の無い環境にも関わらず、1)同一細胞上のべん毛モーター間の回転方向転換が同調すること,2)その同調が受容体の自発的活性化によるリン酸化CheYの濃度の揺らぎにより生じること、3)受容体の自発的活性化が適応システム(CheR、CheB)による受容体メチル化数の変動に起因すること、などがわかってきました(図1、3、文献2、3、4)。これらが意味することは、大腸菌は外部刺激が無くても走化性システムを休ませずに、自発的に受容体を活性化/不活性化させ、リン酸化CheY濃度の揺らぎを産み出し、べん毛モーターの回転方向を同調制御していることになります。これは外界の刺激がない状態においても細胞遊泳をコントロールして常に環境を探索するという大腸菌の生存戦略と考えられます。
■科学的・社会的意義 私達はバクテリアの情報伝達システムを1細胞内のタンパク質動態として計測しています。バクテリアはシンプルな生物ですが、情報伝達はすべての生物に備わったメカニズムです。またシンプルなシステムであるため、生命現象をタンパク質レベルで理解しやすい生き物ともいえます。私たちは大腸菌の情報伝達システムの解明が様々な生物が根源的に持つ情報伝達システムの分子基盤の理解につながると考えています。
■参考文献
1)Fukuoka, H., Sagawa, T., Inoue, Y., Takahashi, H., Ishijima, A. (2014) Direct imaging of intracellular signaling components that regulate bacterial chemotaxis. Science Signal., 7(319):ra32.
2)Uchida, Y., Hamamoto, T., Che, Y.S., Takahashi, T., Parkinson, J.S., Ishijima, A., Fukuoka, H. (2022) The chemoreceptor sensory adaptation system produces coordinated reversals of the flagellar motors on an Escherichia coli cell. J. Bacteriol. 204(12):e00278-22.
3)Che, Y.S., Sagawa, T., Inoue, Y., Takahashi, T., Hamamoto, T., Ishijima, A., Fukuoka, H. (2020) Fluctuations in intracellular CheY-P concentration coordinate reversals of flagellar motors in E. coli. Biomolecules 10(11) 1544-1544.
4)Terasawa, S., Fukuoka, H., Inoue, Y., Sagawa, T., Takahashi, H., and Ishijima, A. (2011) Coordinated reversal of flagellar motors on a single Escherichia coli cell. Biophys. J., 100(9):2193-2200.
■良く使用する材料・機器
1)蛍光顕微鏡システム Ti,Ti2シリーズ(株式会社ニコン).IXシリーズ(株式会社エビデント)
2)EMCCDカメラ iXon3(Andor Technology)
3)sCMOSカメラ ORCA-Fusion(浜松ホトニクス株式会社)
4)高速カメラ FASTCAM AX100(株式会社フォトロン)
 2024年分野別専門委員
2024年分野別専門委員
大阪大学・大学院生命機能研究科
福岡創 (ふくおかはじめ)
https://www.fbs.osaka-u.ac.jp/labs/ishijima/Fukuoka-TOP.html
