細胞の変形と動物の形態形成
Cell shape and animal morphogenesis
■はじめに 細胞は、脂質、核酸、タンパク質といった「物質」で構成されている。物質で構成されている以上、物質科学の法則から逃れることはできない。生物物理学の特徴の一つは、生体分子がどのような物理機構によって分子機能および生命現象を実現しているかを理解しようとするところにある。本稿では、細胞の変形を誘導する化学・力学的メカニズムを概観し、細胞の変形が動物の形態形成に重要な役割を果たしている例について紹介する。最後に、著者らが行った、細胞内の分子動態の計測と、計測に基づいた数理モデル化について説明する。
■細胞の形を決める要素と変形を引き起こすメカニズム
細胞は、単純化すると脂質膜で覆われた液滴と考えることが出来る。液滴も脂質小胞も物理的には拡散性の高い液体の性質をもっており、細胞は球形が安定である。しかし、細胞は、アメーバー状に形態を変化させ移動したり、中心からくびれることにより分裂したりする。このような細胞の変形を誘導する中心的な駆動力を生み出すのは、モータータンパク質と細胞骨格タンパク質である。モータータンパク質は、アデノシン三リン酸(ATP)を加水分解することによって力学エネルギーを生み出す。また、細胞骨格タンパク質は、球状の単分子が数珠つなぎになって繊維状の構造を作り出し、細胞膜の支持体として力学的な変形を引き起こす。また、モータータンパク質と骨格タンパク質は相互作用により束化し、束中の繊維間の滑り運動により繊維束の長さを変える。このように、細胞は細胞骨格の伸び縮みによって変形する。しかし、もし細胞骨格が細胞内で全く無秩序に伸び縮みを繰り返すとすると、細胞は秩序だった移動や分裂を実現することができない。細胞の変形を考える上では、「細胞の特定部位だけ」で骨格の伸縮を行う機構が必要である。「細胞の特定部位だけ」を決定するのが細胞極性システムである(1)。
細胞極性システムは、細胞内で非一様性を作り出す機構である。しかし、脂質小胞や細胞質液滴のどこか一カ所に分子を集めたとしても、拡散によってすぐに一様化してしまい、濃度の偏りを維持することはできない。では、細胞極性システムはどのようにして濃度の偏り(非一様性)を作り出すのであろうか?細胞極性システムの一例として、PAR/aPKCシステムがよく解析されている。
 PARタンパク質は元々線虫(C.elegans)の受精卵の非対称分裂を制御する因子として同定された。PARタンパク質群は、線虫胚の将来の頭側および尾側の細胞表層に相補的に非対称に局在する(図1)。これまでの遺伝学的な解析により、頭側または尾側のどちらか一方のpar遺伝子の一つが欠損した胚では、それとは反対に局在するPARタンパク質の非対称局在が失われ、膜上に一様に分布する。このことから、PARタンパク質は頭側および尾側に局在する因子同士で膜局在を負に制御していることが分かる(「相互抑制機構」)。細胞極性システムが、骨格・モーター系を制御することにより、無秩序な細胞の変形が、秩序だった細胞移動や分裂が可能になる。
PARタンパク質は元々線虫(C.elegans)の受精卵の非対称分裂を制御する因子として同定された。PARタンパク質群は、線虫胚の将来の頭側および尾側の細胞表層に相補的に非対称に局在する(図1)。これまでの遺伝学的な解析により、頭側または尾側のどちらか一方のpar遺伝子の一つが欠損した胚では、それとは反対に局在するPARタンパク質の非対称局在が失われ、膜上に一様に分布する。このことから、PARタンパク質は頭側および尾側に局在する因子同士で膜局在を負に制御していることが分かる(「相互抑制機構」)。細胞極性システムが、骨格・モーター系を制御することにより、無秩序な細胞の変形が、秩序だった細胞移動や分裂が可能になる。
■細胞の変形と動物の発生における形態形成
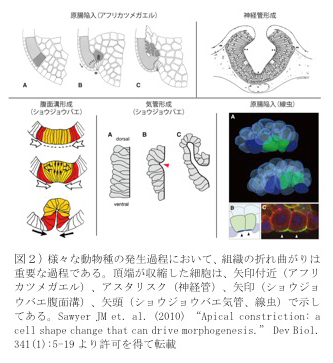
我々人間を含めた動物の発生では、一つの受精卵から様々な種類の細胞が生み出され、動物種により特徴的で機能的な形態が自律的に作り出される。動物の発生における重要なイベントである「原腸陥入」や「神経管形成」は、単純化すると一層の上皮組織の“折れ曲がり”と見なすことが出来る。このシートの折り曲がり部位では、上皮細胞の頂端収縮(apical constriction)が頻繁に観察される(図2)。この頂端収縮は、原腸陥入や神経管形成だけでなく、ショウジョウバエの気管形成や、たった2個の細胞が胚の中心に移動する線虫の原腸陥入細胞運動のように、少数個の細胞が移動する過程でも観察され、組織変形の基本的な過程であると考えられている。また、ヒトの出生後形態異常として神経管の閉鎖異常が知られていることから、組織の折れ曲がりを研究することは、基礎発生生物学のみならず、医療に貢献する研究としても重要である(2)。
この頂端収縮は、細胞の自律的な変形によって引き起こされるのであろうか、それとも、多数の細胞がひしめき合う力学的相互作用の結果なのであろうか?C. elegansはわずか500個の細胞が集まって一つの動物形態(L1幼虫)を形成する線形動物門に属する動物である。この線虫の原腸貫入は26細胞期にわずか二つの原腸細胞が胚の表層から中心に移動することによって引き起こされる(図2右下)。米国North Carolina大学のBob Goldsteinらは、26細胞の胚から原腸細胞を単離して培養し、細胞の動きを観察した。その結果、単離原腸細胞のみでも、原腸陥入運動が起こることが分かった。この結果は、頂端収縮が細胞の自律的な変形により引き起こされていることを示している(3)。
 これまでの研究から、線虫の原腸細胞頂端の収縮部位には、モータータンパク質であるミオシンと細胞骨格であるアクチンが集積しており、この細胞内の非対称性は、PAR/aPKCシステムが作り出していることが明らかになっている。これらの観察をまとめると、モータータンパク質であるミオシンと細胞骨格が、上皮細胞の“頂端のみ”を収縮させ、細胞を変形させ、その結果、組織の変形が誘導されると考えられている。つまり、細胞の変形が、動物の発生における形態形成の駆動力の一つであると考えられるのである。
これまでの研究から、線虫の原腸細胞頂端の収縮部位には、モータータンパク質であるミオシンと細胞骨格であるアクチンが集積しており、この細胞内の非対称性は、PAR/aPKCシステムが作り出していることが明らかになっている。これらの観察をまとめると、モータータンパク質であるミオシンと細胞骨格が、上皮細胞の“頂端のみ”を収縮させ、細胞を変形させ、その結果、組織の変形が誘導されると考えられている。つまり、細胞の変形が、動物の発生における形態形成の駆動力の一つであると考えられるのである。
■細胞の変形によって組織変形が誘導される —Tensegrity model— 細胞の変形によって「原腸陥入」や「神経管形成」で見られるような「シートからTubeへの変形」が引き起こされるというアイデアは、既に1947年の米国ペンシルバニアのWistar解剖学生物学研究所のWarren H. Lewisの報告にみることが出来る(4)。彼らは、爪楊枝大の真鍮の棒と輪ゴムを組み合わせて原腸陥入を説明する“物理モデル”を報告している。このモデルでは、平行に並んだ2本の真鍮棒の間に一本の真鍮棒を配置してH文字型を作る。H文字の上端に突出した2端に輪ゴムを1つずつかける。このとき、直交する真鍮棒は平行に並んだ真鍮棒の支えになる。このHを一つの“細胞”に見立てる。さらに、平行の棒を数珠つなぎで増やしていくと、“細胞シート”ができる。頂端と基底の輪ゴムの数が同じ時は“細胞”は長方形のままであるが、どちらかの端の輪ゴムを増やすと“細胞”は楔(くさび)型に変形する。それに伴って、“細胞シート”も一方に折れ曲がり、最終的にはTube構造を形成する。輪ゴムの数を一端だけで増やすことは、細胞極性システムによってモーター・骨格タンパク質が細胞の一端を収縮させることに対応する。簡単な材料で生物システムの本質を説明する非常にユニークな取り組みである。今日では、このようなモデルは、Tensegrity (テンセグリティ)modelとよばれている。Tensegrityは、Tense(張力)とIntegrity(統合)からできた造語である。
■発生現象の複雑性・自律性 Goldsteinらの実験は、確かに細胞の変形が組織変形の基礎になっていることを示している。さらに、古典的なTensegrityモデルは、「細胞の一端が収縮し、それにつられて組織が変形する」という非常に明解な「因果関係」を提示している。しかし、Goldsteinらが報告した部分胚での細胞変形は、正常胚の中で見られる変形の程度よりはるかに小さい。このことは、細胞個々の変形だけでなく、複数の細胞の変形に伴う“押し合いへし合いの力”も組織変形に寄与していることを示唆している。細胞個々の変形と細胞間の力の均衡を基礎にした細胞の集団運動が組織変形の本質であるとすると、我々が人ごみで一直線に目的地に向かえないように、細胞は移動する細胞集団の中で臨機応変に移動の力・方向を変える必要がある。これが本当だとすると、細胞は状況の変化に対してある種の計算を行い、状況に応じて振る舞いを変化させる「自律性」・「調節性(適応性)」が備わっていることになる。ウニやカエルの発生では、発生初期の細胞を分離して別々に培養しても、正常なプロポーションの幼生ができる。このことと合わせても、動物の形態形成を理解する上で、細胞の「自律性」・「調節性(適応性)」を理解することは、古典的かつ重要な問題である。細胞の集団運動や発生の調節性を説明するには、これまでの分子遺伝学的手法が得意とし、Tensegrityモデルが明確に示すような単純な因果関係だけでは不十分である。細胞が持つであろう、細胞の「状況依存的な柔軟な振る舞い」、「自律性」を理解するにはどうしたら良いであろうか?
■細胞内の分子運動を計測し、「細胞極性」を再現する数理モデルを構築する
細胞極性システムは、タンパク質局在を一様化する「拡散」に対抗して、極性タンパク質の非対称局在を頑健に維持しなければならない。同時に、細胞の外環境の変化に対して、非対称局在を柔軟に応答させなければならない。これまでの生物物理分野の研究によって、細胞骨格やモータータンパク質の「自律性」・「適応性」については解析が進んでいる(5、6)。しかし、極性形成システムの「自律性」・「適応性」については生物物理学的な解析が遅れていた。障壁は、正常に発生プロセスを進行させる生細胞内でのタンパク質動態を計測する技術的基盤が脆弱であったことと、非対称局在を作る素子であるタンパク質分子と細胞膜上の非対称局在パターンのスケールの違い(タンパク質はナノメートル大、パターンはマイクロメートル大。その違いは長さにして1000倍ある)を扱う難しさにあった。
最近著者らは、生物物理分野で発展してきた1分子顕微計測技術(1分子イメージング(SMI)および蛍光相関分光法(FCS))を線虫受精卵に適用し、生細胞内で極性タンパク質PAR-2の挙動を計測することに成功した。特に、1分子イメージングでは、タンパク質が細胞表層を動き回る様子を可視化する(図3)ことができるため、蛍光輝点の挙動を追跡・解析することにより、拡散係数、解離・結合定数、および分子の重合度と、それらの空間分布を決定することが出来る。我々は細胞内のタンパク質動態を「膜および細胞質における側方移動(2過程)」と「膜・細胞質間の交換反応(2過程)」に分類し、SMIとFCSを組み合わせ、細胞表層と細胞質の計測を行い、上記の4過程すべてを特徴づける物理パラメーターを取得した。計測の結果、膜および細胞質でのPAR-2の側方運動が拡散で記述できること。PAR-2が膜上から解離する速度と、細胞質から膜に結合する速度が、胚の頭—尾軸に従って変化することを明らかにした。特に、PAR-2には、これまでに考えられていたよりも、膜上を側方に移動できないほど速い速度で膜から解離する新しい成分があることを明らかにした。これらのPAR-2の非対称局在がどのようなバランスによって成立しているかを理解するために、計測によって得られた値に基づいて数理モデルを決定した。この数理モデルは、計測で決定した解離・結合関数および拡散係数解離関数の値に変更を加えること無く、システムの双安定性によって非対称局在を維持することが分かった。このように、我々は、生細胞内タンパク質動態を包括的に計測することによって、生細胞内のパラメーターバランスを反映した数理モデルを構築することに成功した。
我々が新しく同定した「解離が早いPAR-2の成分」は、極性を維持するためにどのような役割を担っているのだろうか?我々は、数値計算によって得られた膜上の非対称局在の定常分布に、ランダムな値を加えることによって膜上の密度ゆらぎからの回復過程を調べた。面白いことに、解離が早いPAR-2の成分の存在により、非対称局在を脅かす膜上での密度揺らぎが速やかに細胞質へ移行させられ、ゆらぎ成分は細胞質中で解消されることが明らかになった。この数理モデルは、細胞内の実際のタンパク質動態を反映していることから、実際の線虫胚でも膜上の極性タンパク質の密度ゆらぎを細胞質に引き受けさせることにより安定性を維持する機構が機能していると考えられる。
また、線虫の初期胚でも、動物の初期発生過程で一般にみられるように、卵割によって細胞が小さくなる。線虫の生殖細胞系譜にあるP3細胞は受精卵に比べ直径にして約6倍小さいにも関わらず、PAR-2タンパク質は非対称に局在する。この非対称局在は、胚からP3細胞を単離し細胞外シグナルがない状態でも形成される(7)ことから、P3細胞の極性形成は受精卵における非対称局在と同様に、細胞外のシグナルに依存しないシステムにより形成されている。今回我々が同定した、膜からの解離が早い成分は、結果として膜上での側方拡散距離を短くするので、この「解離が早いPAR-2の成分」によって、小さい細胞での非対称局在を維持するのに有利である。以上の結果をまとめると、線虫のPAR-2の非対称局在は、膜からの解離速度が早い成分の存在によって、熱ゆらぎによる拡散の効果を細胞質に引き受けてもらい「安定性」を担保すると同時に、卵割によって細胞サイズが小さくなってもこの変化に適応して非対称局在を維持するのに適したパラメーターバランスになっていたことが分かった。線虫は、進化の結果、このような「安定性」と「適応性」を同時に実現するパラメーターバランスを獲得したと考えられる(投稿準備中)。
■終わりに 我々の細胞極性システムの生物物理学的研究を、モーター・骨格系の理解と統合し、動物の発生における細胞の特性を解析することができる時代になってきた。分子・細胞の「自律性」・「適応性」に注目した生物物理学的アプローチを動物の発生(組織変形)の力学的基本原理の解明に役立てることにより、これまでの因果関係に基づいた理解を超えて、より柔軟で自律的な生命システムの特性を生み出す物理的な基盤を明らかにできるはずである。これらの知見を、近年発展の目覚ましい幹細胞研究と融合させることにより、試験管内で移植用の組織・器官を自由に設計・構築することも可能になるかもしれない。
■参考文献
1) Alberts et. al. Molecular Biology of the Cell 5th edition
2) Sawyer JM et. al. (2010) “Apical constriction: a cell shape change that can drive morphogenesis.” Dev Biol. 341(1):5-19
3) Lee JY, Goldstein B. (2003) “Mechanisms of cell positioning during C. elegans gastrulation.” Development. 130(2):307-20
4) Warren H. Lewis (1947) “Mechanics of invagination”. The Anatomical Records 97(2): 139-159
5) 宝谷紘一・神谷律:シリーズ・ニューバイオフィジックスII-5「細胞のかたちと運動」
6) 柳田敏雄:岩波講座 物理の世界 物理と情報7「生物分子モーター ゆらぎと生体機能」
7) Arata Y et. al. (2010) Extracellular control of PAR protein localization during asymmetric cell division in the C. elegans embr /yo. Development. 137(19)
The standard identifier:20140307csm
■良く使用する材料・機器
1)倒立顕微鏡(株式会社ニコン)
2)EM‒CCD カメラ (浜松ホトニクス株式会社)
3)488 nmレーザー(コヒレント・ジャパン株式会社)
 H24年度分野別専門委員
H24年度分野別専門委員
理化学研究所・佐甲細胞情報研究室
荒田 幸信(あらた ゆきのぶ)
https://www.riken.go.jp/cell-info/member/
