タンパク質設計・ドラッグデザイン
「設計して迫るタンパク質の立体構造構築原理」
■背景
タンパク質は、20種類のアミノ酸が一次元的につながった鎖状高分子であり、そのアミノ酸配列に従って固有の三次元立体構造へと折りたたみ機能を果たします。アミノ酸配列はどのような原理によって折りたたむ構造を決めているのでしょうか?この“折りたたみ問題”が解明されれば、アミノ酸配列に基づいて折りたたむ構造を予測することも、またその逆に、望みの構造に折りたたむアミノ酸配列を自在に設計することも可能になります。ここでは、タンパク質の構造を完全にゼロから設計することにより、タンパク質の構造がどのようにして決められているのか、その立体構造構築原理に迫ります。
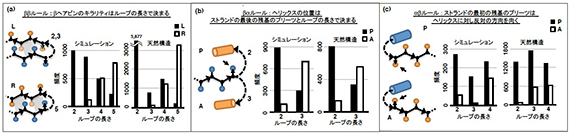
図1 局所主鎖構造と三次構造モチーフに関するルール(文献1より引用)
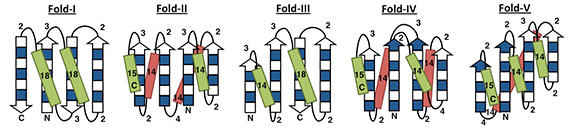
図2 ルールに従い決定された主鎖構造の設計図(文献1より転載)
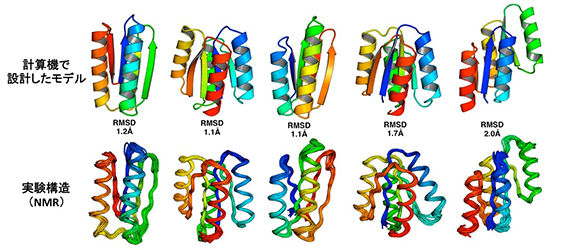
図3 計算機で設計したモデル(上)とNMRで解かれた構造(下)との比較。RMSD: 平均二乗偏差(文献1より転載)。
■研究概要 タンパク質の構造を完全にゼロから設計しようとしたとき、まずどのようなトポロジーの構造を作りたいのかを決めます。次に、その主鎖構造を実際に計算機で設計していきますが、このとき、各々の二次構造の長さやループの長さを決める必要があります。私たちは、計算機による折りたたみシミュレーションと自然界のタンパク質構造を網羅的に統計解析することにより、二次構造やループの長さといった局所主鎖構造が三次構造モチーフの決定に重要であることを発見し、それらの関係性を3つのルールとして体系化しました(図1)。そして、これら3つのルールに従って、設計したいトポロジー(Fold-I~V)の二次構造やループの長さを決定することにより、主鎖構造設計図を描きました(図2)。その設計図に基づいて主鎖構造を構築し、さらにその主鎖構造を安定にする側鎖構造(アミノ酸配列)を設計することにより、私たちは、5つの異なるトポロジー(Fold-I~V)について、立体構造を完全にゼロから計算機上で作り出しました。このようにして設計したタンパク質のアミノ酸配列を、大腸菌に組み込み発現・精製し、生化学実験によって折りたたみ能を測定したところ、これらのタンパク質は100℃付近でも変性しない安定な構造を形成していました。さらに、これらの構造をNMRによって解いたところ、計算機上で設計したモデルとNMRで決定された構造は、原子レベルの精度で正確に一致していました(図3)。これらの結果は、アミノ酸配列の詳細というよりはむしろ局所主鎖構造が折りたたむ構造を決定していることを示唆しています。
■科学的・社会的意義 ここで紹介した望みの構造に折りたたむタンパク質を自在に設計する技術を用いて、自在に機能性タンパク質を設計することができるようになれば、様々な病気に対するテーラーメイドな治療薬開発や生体に親和性の高いマテリアル開発による医療への貢献、新規酵素開発による産業への応用などが期待されます。
■参考文献
1)Koga, N., Tatsumi-Koga, R., et al. (2012). "Principles for designing ideal protein structures." Nature 491(7423): 222-227.
2)Lin, Y.-R., Koga, N., Tatsumi-Koga, R., et al. (2015). "Control over overall shape and size in de novo designed proteins." Proc. Natl. Acad. Sci. USA 112(40): E5478-E5485.
■用語解説 トポロジー:配列に沿った二次構造の順番と、その三次元的な空間配置
■良く使用する材料・機器
1) 円二色性分散計 J-1500KS (日本分光株式会社)
2) 高速液体クロマトグラフシステム HPLC 1260 Infinity (アジレント・テクノロジー株式会社)
3) 多角度光散乱検出器 miniDAWN TREOS-KG (Wyatt Technology Corp)
4) 実験試薬 (和光純薬工業株式会社、シグマ アルドリッチ ジャパン合同会社)
 H27年度分野別専門委員
H27年度分野別専門委員
自然科学研究機構 分子科学研究所
古賀信康 (こがのぶやす)
https://www.ims.ac.jp/research/assoc/koga.html
「構造情報と進化工学によるタンパク質設計」
■背景 タンパク質は、アミノ酸が脱水縮合したポリマーであり、その配列情報に従って折りたたまれてドメインと呼ばれる立体的な構造を形成しています。このドメインが持つ3次構造と機能の情報は日々蓄積されており、現在蓄積されているドメイン単位の構造・情報データベースは、膨大な機能分子集団(ライブラリー)と捉えることができます。また、現在では、部位指定突然変異のように特定位置の残基を自在に変異させることや、一次構造レベルではありますが、自分の好きなアミノ酸配列を持つタンパク質を合成することが出来きます。特に、いくつかの特定残基をランダムに変異させたライブラリーを作成し、その中から機能が向上したものや目的機能を持ったタンパク質を選択する方法(ライブラリー法)も開発され、タンパク質を合理的に設計する技術は着実に進展しています。ここでは、ファージ提示法を用いた局所ライブラリー法によって新しい機能を持つタンパク質を作成した研究を紹介します。
図1. ファージ提示法
図2. ペプチド移植と局所ライブラリー法を利用した無機材料表面結合性抗体の取得
■研究概要
ファージはウィルスの一種で、そのDNAの特定箇所に遺伝子を挿入すると、その遺伝子に従ったタンパク質をpIIIと呼ばれるコートタンパク質のN末端に抗体断片を融合発現させることができます。この時、挿入する遺伝子配列をランダムにておくと、アミノ酸配列が異なったタンパク質が各々、別々のファージ表面へ提示されることになります。そして、このファージライブラリーの中に標的の目標となる分子を表面に固定化した磁性粒子を加え分離を行う操作を繰り返すと、粒子表面に目的の標的分子に結合するタンパク質を提示したファージのみが選択されていきます(図1)。
私達は、この手法を天然にはない工学材料に選択的に接着するタンパク質を作製するために利用しました。まず、アミノ酸12残基程度のポリペプチドを提示したファージライブラリーを用いて、多機能セラミックスである酸化亜鉛表面に弱いながら結合するペプチドを選択しました。その後、ラクダ由来の抗体ドメインの分子認識領域にある1つのループ構造(CDR1)のアミノ酸配列を選択されたペプチドのアミノ酸配列に置換することによって、抗体ドメインに酸化亜鉛表面に結合する機能を付与しました。そして、さらに、他のループ構造(CDR3)のアミノ酸配列をランダムにしたライブラリーを作製し、結合力を数十倍高めた抗体ドメインを選択することができました(図2)。
■科学的・社会的意義 結合する対称として無機材料表面という非常に特殊なものを扱った例を紹介しましたが、特定分子に選択的に結合するタンパク質の設計は、現在の医薬品開発において重要な技術のひとつです。また、酵素の高機能化についても、タンパク質構造に基づいた局所配列のライブラリー法は有効であり、酵素の産業利用に貢献しています。
■参考文献
1)Umetsu, M., Mizuta, M. et al. (2005). “Bioassisted room-temperature immobilization and mineralization of Zinc Oxide - High order structuration of ZnO nanoparticles to a flower-type morphology-”, Adv. Mater. 17: 2571-2575.
2)Hattori, T., Umetsu, M. et al. (2010). “High Affinity Anti-inorganic Material Antibody Generation by Integrating Graft and Evolution Technologies. POTENTIAL OF ANTIBODIES AS BIOINTERFACE MOLECULES” , J. Biol. Mol. 285: 7784-7793.
H25年度分野別専門委員
東北大学・タンパク質工学
梅津光央 (うめつみつお)
https://www.che.tohoku.ac.jp/~kuma/index.html
(2009/06/23)
1.生物物理学者は、DNA情報の持つ真の意味を解読します。 タンパク質は、DNAの持つ遺伝情報に従って20種類のアミノ酸が並んだ(アミノ酸配列という)1本の鎖ですが、生理的な環境下では、それぞれのタンパク質毎に固有の「かたち」をとって機能を発揮します。この「かたち」自体が、DNAの遺伝情報にフィードバックされて、進化の過程で保存され、また分化してきたと考えられています。生物物理学者は、どうして、それぞれのDNA情報であるアミノ酸配列が、固有の「かたち」に対応するのだろう?ということを理解したいと考える人種です。これは、他の多くの生物学者が、タンパク質という分子はそういうものだ、と受け入れてしまうのに対し、生物物理学者だけが「なぜ、タンパク質は多様なかたちをするのだろう?」という素朴な疑問を持ちつつけているからです。そのアプローチも多様であり、6万種ほどのタンパク質のかたちの情報(PDBデータベース: Protein Data Bank)とアミノ酸配列との対応関係から帰納的にその原理を学ぼうとうする一方、物理化学的な解析から演繹的な分子シミュレーションによってエネルギーが低い安定なかたちを一義的に求めようともしています。また、もし、その対応関係を人間が完全に理解できれば、その時には、逆に、人間がアミノ酸配列を設計することによって望みの「かたち」のタンパク質を創りだせるはずです。
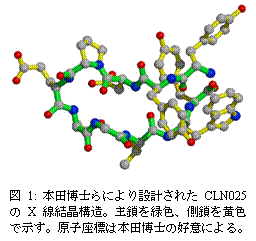
産総研の本田真也博士らは、わずか10ヶのアミノ酸がつながった小さなタンパク質(通常のタンパク質は100から1000程度のアミノ酸が並んでいます)を、上記の帰納的および演繹的手法の双方を取り入れて、ヘアピン型のかたちをとるように設計(アミノ酸配列はTyr-Tyr-Asp-Pro-Glu-Thr-Gly-Thr-Trp-Tyr)し、CLN025と名づけました。このペプチド鎖は水中でたいへん安定で、望みのようにヘアピン型をしている(図1)ことが、X線をあてて得られた回折像の解析によって確認されています[1]。また、天然タンパク質と同様、高温でそのかたちが壊れることも観察されています。すなわち、まるでJ. F. シャンポリオンが古代エジプト文字で書かれたロゼッタ・ストーンの碑文を解読し、さらにはそこで使われた言語で新たな文章を書くことができたように、生命の基になっているタンパク質分子において、そのDNAの持つ情報がタンパク質のかたちを決める仕組みを解読し、短いセンテンスではあるものの、10ヶのアミノ酸からなる新しいタンパク質という文章を書くことに生物物理学者が成功したわけです。
2.生物物理学者は、合理的に薬を創りだします。 薬は、昔は「生薬」としてハーブや特殊な植物や動物から抽出したものが試行錯誤の結果として使われてきました。近代になって、それらの元になっていた低分子化合物の同定が進み、有機化学的手法によってさらに効果的な薬を合成したりバクテリアが創る低分子化合物を探索したりすることにより、多くの薬が作られ使われています。多くの薬は、タンパク質やDNA等の生体分子の働きを阻害しており、今では、薬の標的となるタンパク質の「かたち」を高い精度で解析し、その働きを阻害するような探索(スクリーニングと呼ばれる)や設計が行われるようになっています。ここでも、生物物理学者は、単に薬が効けばよい、という考えでなく、なぜ薬が効くのか(標的タンパク質の働きをどのようにして阻害するのか)ということを理解したいと思い、その阻害の様子を解析します。 阪大工・井上豪博士らは、抗炎症剤や抗アレルギー剤として有効なプロスタグランジンD合成酵素(H-PGDS)の阻害剤が、どのような仕組みで働いているかを理解するため、既知の薬であるHQL-79との複合体のかたちをX線回折実験により決定しています(図2)[2]。
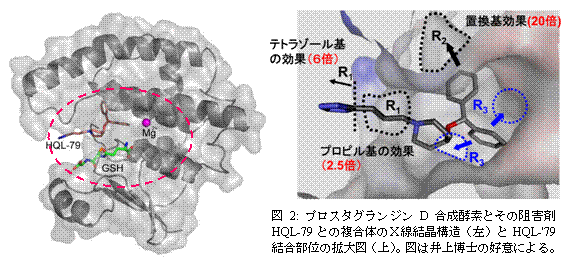
この複合体の「かたち」から、阻害剤HQL-79のプロピル基を長くしたり、ポケットの奥にはまり込むジフェニル基を置換したりして、よりポケットにぴったりとはまり阻害効果が強くなる低分子化合物を設計・合成したところ、既知の薬よりもはるかに強い阻害活性を見出すことができています。
実際の薬として利用されるためには、マウスなどを用いた生体に対する実際の検証を行い、最終的には人間に対する効果や副作用が起きないことを確認する必要があります。しかし、全く新しい薬の種(シード)を創りだす研究は、このように生物物理学者が得意とする分野であり、薬学研究者との共同研究によって、実際に利用されうる薬を開発する研究が進んでいます。
3.生物物理学者は、インフルエンザ・ウィルスにも立ち向かいます。 2009年春先にメキシコでの大規模感染に端を発したブタ・インフルエンザ・ウィルスは世界中に蔓延し、パンデミックと認定されるほど深刻な事態となったのは、皆さんもご存知のとおりです。ただし、今のところ見つかっている新型ウィルスには、これまでの特効薬として知られているタミフル(Oseltamivir)が効果があると言われています。もともとタミフルは、前述したプロスタグランジンD合成酵素阻害剤と同様に、インフルエンザ・ウイルスの酵素タンパク質ノイラミニダーゼ(NA)の触媒機能を阻害する効果を持つ薬として開発されたものです。図3aのように、H5N1トリ・インフルエンザ・ウィルスのNAの触媒部位のポケットにピッタリはまり込んで、酵素機能が発揮できなくしている様相を見ることができます[3]。生物物理の研究者がその開発にも関わっている、コンピュータによるモデリング技術の一つであるホモロジー・モデリングの方法によって、新型ブタ・インフルエンザ・ウィルスのゲノム解析から得られたNAタンパク質のアミノ酸配列に基づいて、その立体構造モデルを作り、タミフルが結合できる様子を調べられます(図3b, c)。このモデリングの技術は、今では誰でもWeb上のサービス(例えば阪大蛋白研で開発した Spanner など)によって利用することができます。
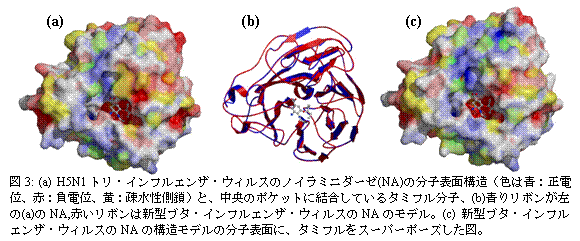
また、先に述べた創薬の方法で、インフルエンザ・ウィルスのNA以外の他のタンパク質の機能を阻害する薬のシーズを発見することにも生物物理学者は力を注いでおり、生命とは何か、という問いかけに始まり、人間の健康増進に役立つ応用研究によって、直接社会に役立つ寄与を果たしています。
■参考文献
[1] Honda, S. et al. (2008) Crystal structure of a ten-amino acid protein. J. Am. Chem. Soc. 130, 15327-15331.
[2] 井上豪、裏出良博(2007) 阻害剤開発のための2種のプロスタグランジン合成酵素の構造と機能.生物物理47 (1), 36-43.
[3] Russel, R. J. et al. (2006) The structure of H5N1 avian influenza neuraminidase suggests new opportunities for drug design. Nature 443, 45-49 (PDBID: 2hu0-chain B).
大阪大学・蛋白質研究所・蛋白質情報科学研究系 中村春木
