培養細胞
「細胞膜と細胞骨格のインターフェースをつなぐことで、細胞の形態形成の不思議に迫る」
■背景
細胞は細胞膜によって外界と区画されることで、生命の基本単位として定義されています。細胞膜の形態変化は、がん細胞の浸潤・転移などに見られる細胞運動や細胞接着、細胞分裂、分化などの基本的な生理機能に伴う必須のメカニズムです。細胞膜は、脂質分子によって二重層を構成し、細胞膜の形態は細胞骨格によって支えられています。細胞膜と細胞骨格の協調によって細胞の形態は形成されています。
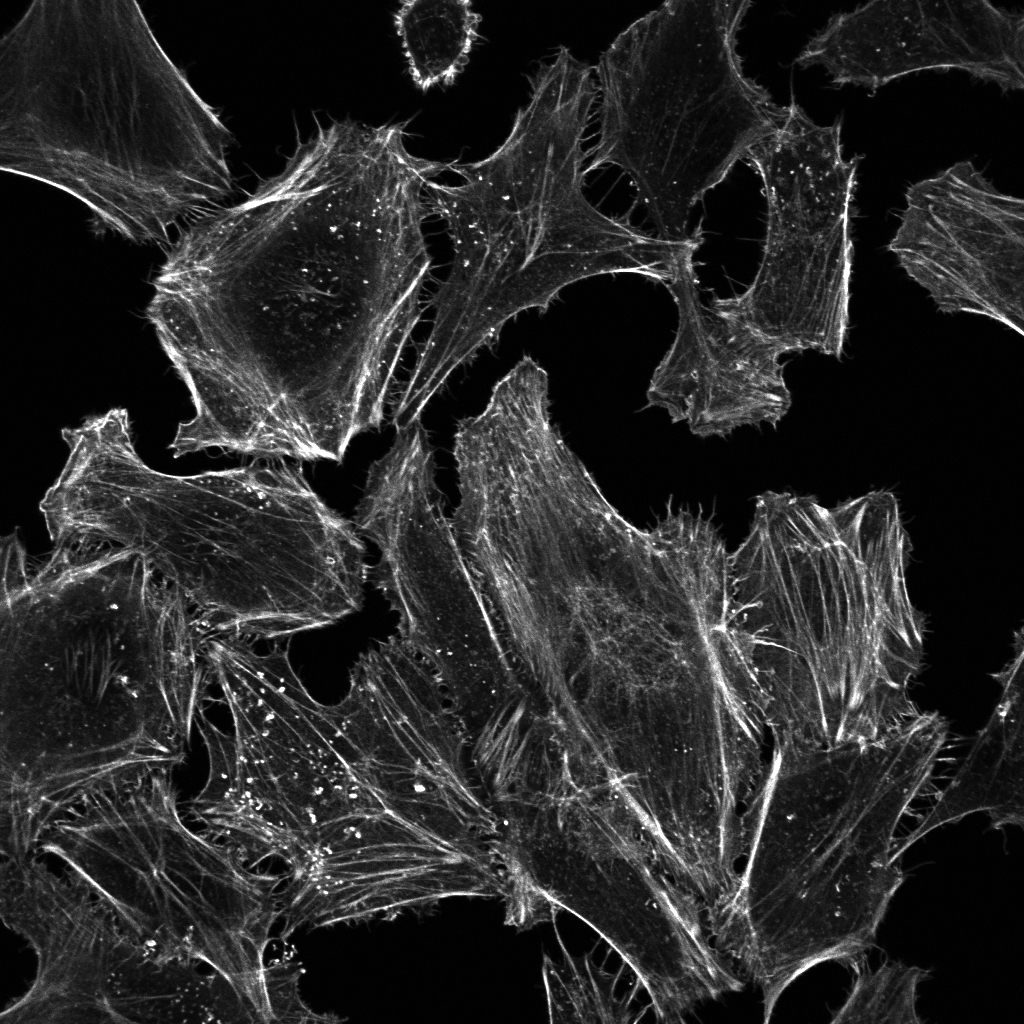
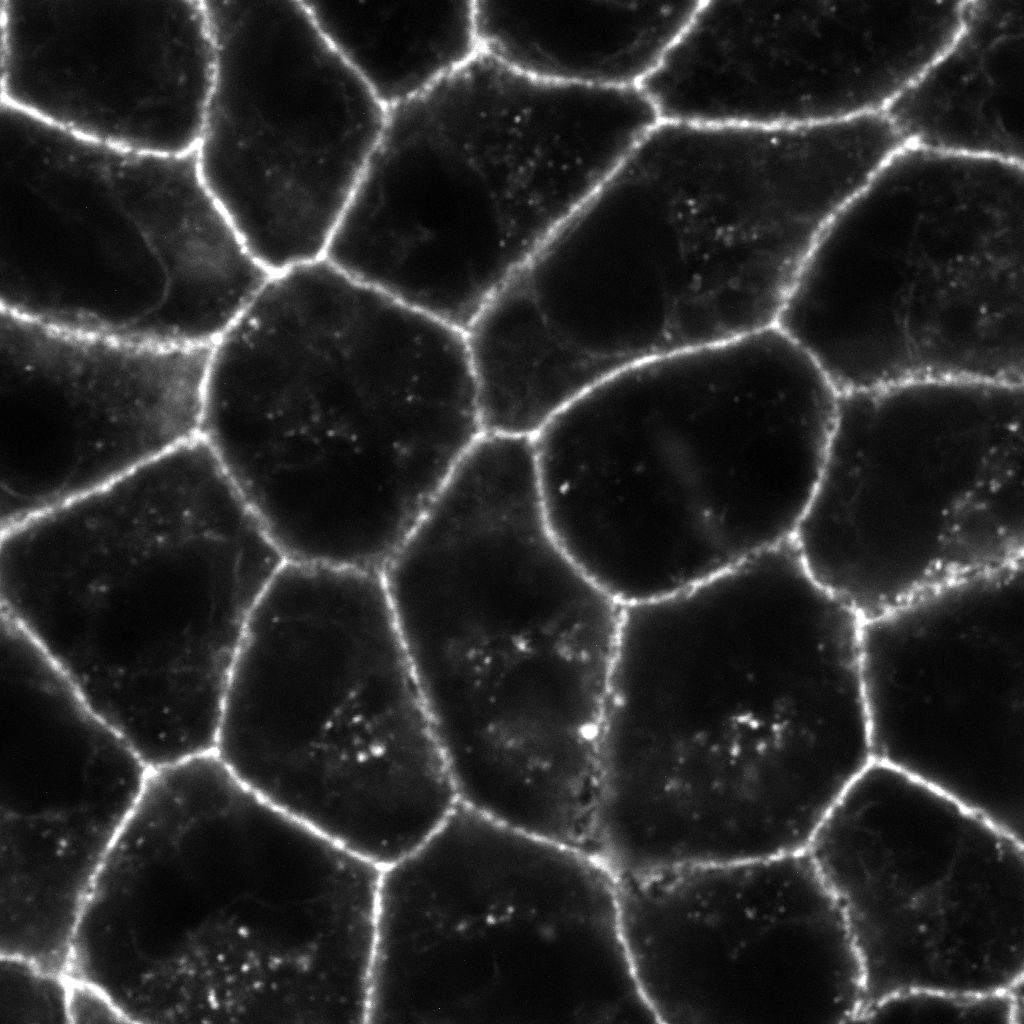
図 (左) 培養細胞のアクチン細胞骨格をファロイジンで染色して蛍光顕微鏡で観察すると、細胞膜の形態形成を担うラメリポディア (葉状仮足) やフィロポディア (糸状仮足) 、ストレスファイバーが観察されます。(右) 上皮細胞のアクチン細胞骨格をファロイジンで染色して蛍光顕微鏡で観察すると、アドヘレンスジャンクションを維持するアクチン細胞骨格が観察されます。
■研究概要
動物などの生体組織から分離し、生体外で増殖・維持された細胞を培養細胞と呼びます。取り扱いが単純な系として樹立された培養細胞を顕微鏡で観察することで、細胞膜の形態形成を制御するタンパク質の機能を定量的に明らかにし、分子メカニズムとその背後に潜む物理法則を明らかにしています(図、文献1-2)。
■科学的・社会的意義
細胞の形作りがどのような物理法則に支配されているか明らかにするのに役立ちます。また、がんなどの疾患の予防、病態解明や新たな治療法の開発などにも応用されます。
■参考文献
1) Senju Y, et al. A biophysical perspective of the regulatory mechanisms of ezrin/radixin/moesin proteins. Biophys Rev. 2022 Jan 28;14(1):199-208.
2) Senju Y, et al. Moesin-ezrin-radixin-like protein merlin: Its conserved and distinct functions from those of ERM proteins. Biochim Biophys Acta Biomembr. 2023 Feb;1865(2):184076.
■良く使用する材料・機器
1) 倒立顕微鏡 ECLIPSE Ti2 (株式会社ニコン)
2) 共焦点レーザー走査型顕微鏡 FV3000 (株式会社エビデント)
3) 試薬 (富士フイルム和光純薬株式会社)
2023年度分野別専門委員
岡山大学・異分野基礎科学研究所
千住 洋介 (せんじゅう ようすけ)
https://researchmap.jp/senju
「細胞操作メカノバイオミメティックマテリアルの創製」
■研究概要
1. 微視的培養力学場設計による細胞運動制御:メカノタクシス誘導条件の決定
生体内における細胞の形態・運動性・機能は,その細胞の属する組織が感受する種々の静的ないし動的な力学環境(生体力学場)により重要な調節を受けています.このような細胞外力学環境の設計・制御は,細胞行動と機能の制御とともに適切な組織形成誘導の基礎として,再生医工学用人工基材(骨格基材や 人工細 胞外マトリックス等)の開発における主要課題の一つです.この課題に対しては,人工基材における細胞外力学環境の微視的レベルでの設計と,その結果誘導される細胞行動・機能調節および組織の力学応答との間の関係を系統的に把握することが必要です.
本研究では,微視的細胞培養力学場の設計とそれによる細胞行動の応答の系統的相関解析に焦点を当て,特に,細胞のメカノタクシス制御条件の確立を進めています.メカノタキシス(mechanotaxis)は細胞が周囲組織のより硬い領域を指向して移動する性質(機械的走性)であり,細胞増殖 因子等の生化学分子の濃度勾配感受性のハプトタキシス(haptotaxis)とともに,材料設計に基づく細胞運動操作技術の基盤の一つとして注目されています.細胞のナノメカニクス解析に基づき,メカノタキシスの方向および速度等を定量的に制御し得る二次元あるいは三次元の人工基材の力学環境条件を明らかにし,その微細設計・分子設計の指針に応用します.
2. メカノバイオミメティックスアプローチによる幹細胞操作ゲルの開発:弾性マイクロパターニングゲルを用いた幹細胞フラストレーション運動の誘導
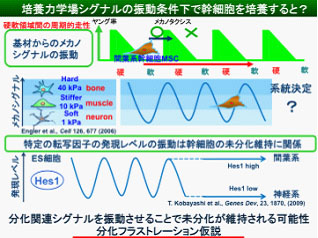
生体内における幹細胞の機能制御は幹細胞ニッシェと呼ばれる細胞外の微視的環境条件に強く依存します.その人工的再現のための工学的取り組みは幹細胞操作技術開発の目標の一つです.その取り組みに関して近年,幹細胞の分化系統が,生体組織力学場に類似した弾性特性を有する培養基材条件に依存して決定され得るとの知見が注目を集め,メカノバイオミメティックな幹細胞操作技術の基礎として期待されています.このような課題に関連し,当研究室ではこれまでに,細胞培養基材の微視的力学場設計による細胞挙動の系統的評価と,それに基づく細胞操作・機能制御の研究を進めてきました.光硬化性ハイドロゲル材料に対する精密マイクロ弾性パターニング技術を独自に確立することにより,メカノタクシスとして知られる細胞の硬領域指向性運動の制御を可能としています.その研究の過程で最近,幹細胞操作に関わる興味深い現象~幹細胞分化フラストレーション~を見出しました.
すなわち,硬・軟領域を微細パターン化したゲル上で,間葉系幹細胞(MSC)を培養すると,MSCは基材上の硬・軟いずれへの領域へも定住しない運動モードを示しますが,そのような状態で1週間培養した後にMSCの幹細胞性を評価したところ,MSCの各種幹細胞マーカーの発現および神経・筋・骨分化 マーカーの発現抑制を示し,通常のプラスチックシャーレ上での培養に比べ,より良質の未分化状態を維持していることがわかりました.MSCは培養床の弾性率に依存して異なる細胞種へ分化することが報告されており,もし硬・軟領域のいずれかに一定時間以上定住すると,特定の系統への分化方向の決定が起こるが,以上の観察は硬・軟領域をランダムあるいは周期的に経験させるとMSCの系統決定がブロックされるものと考えられ,幹細胞の未分化能維持マトリックスとしての機能が発現する可能性を示しています.我々は独自にこのような培養モードを幹細胞の“分化フラストレーション”と名付けました.現在,この分化フラストレーション現象の詳細および幹細胞の未分化維持材料としての応用性を検討しています.
H24年度分野別専門委員
九州大学先導物質化学研究所・生命分子化学分野
木戸秋 悟(きどあき さとる)
https://www.cm.kyushu-u.ac.jp/mbbmc_imce_new/
