電子状態理論・分子軌道
「生命を電子状態から考え、生体分子の仕組みを理論的に解明する」
■背景
生命は活動に必要な化学反応を促進させるために酵素(タンパク質)を利用しています。酵素は全体の形が定まっているだけでなく、反応を起こす場所、活性中心も構造が決まっており、反応に最適化されています。それにより、酵素反応は高活性、低コスト、高耐性の優れた特性を持っています。また基質(反応物)の選択的結合や反応制御の仕組みを持っていることで、様々な高次調節を備えることで、生命活動に役立っています。近年、X 線結晶構造解析の進展により、高分解能構造や反応途中の構造が直接観測できるようになってきました。新たな構造知見を基に、理論解析は、生体内化学反応の機能発現機構のより詳細な解明と検証を行います。
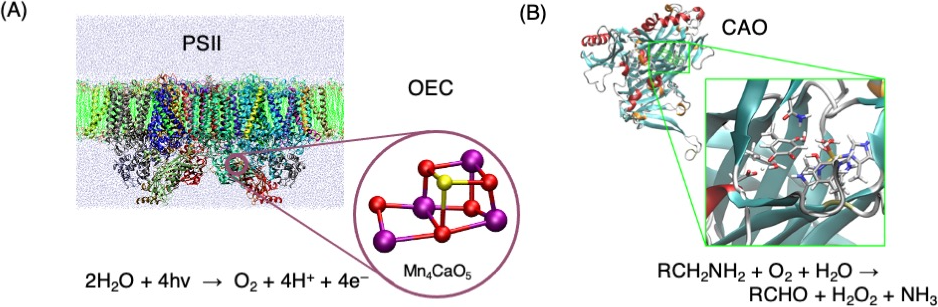
図1 (A)光合成光化学系I I(PSII)における酸素発生中心での水分解反応(B)銅含有アミン酸化酵素(CAO)でのトパキノン補酵素による酸化反応
■研究概要
理論解析では、量子力学に基づく電子状態計算や動的挙動を解析する古典分子動力学計算、それらを組み合わせた量子古典混合計算法(QM/MM)を利用して、反応特性を解析します。理論解析は、実験的手法と組み合わせることで分子レベルでの詳細な反応過程を明らかにします。具体的には我々は、光合成光化学系IIにおける水分解反応と銅含有アミン酸化酵素におけるアミン類酸化反応について理論解析を進めています(図1、文献1,2)。通常進まない反応でも酵素は起こすことができ、その仕組みは実現可能であるにもかかわらず人智を超えている場合が多く、そのエレガントな解法に大変感激することが多々あります。また、アミノ酸ホモキラリティ問題は生命の起源に深く関連する大きな謎ですが、我々は分子物性の精密理論解析の観点から探求しています(図2、文献3)。
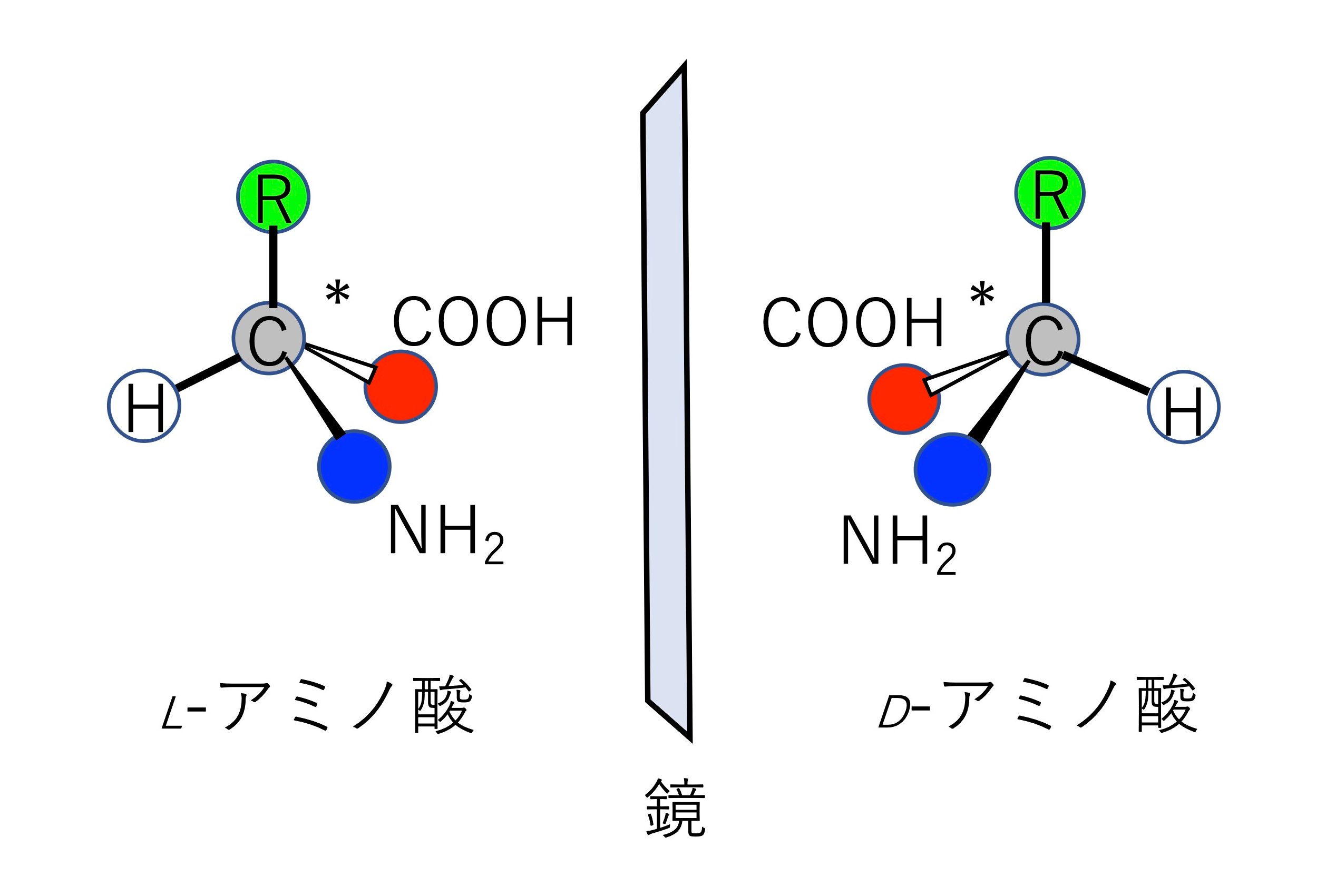
図2 地上生命はL-アミノ酸を選択し、鏡像異性体であるD-アミノ酸を選択しなかったのは何故なのか?このアミノ酸ホモキラリティ問題の解決は、生命起源を紐解く大きな手がかりになる。
■科学的・社会的意義 本研究は、人工光合成の分子設計や次世代エネルギー変換技術設計に役立ちます。アミノ酸ホモキラリティ問題から、生命起源に迫ります。
■参考文献
1)M. Shoji, H. Isobe, et al., “Concerted mechanism of water insertion and O2 release during the S4 to S0 transition of the oxygen-evolving complex in photosytem II”, JPCB, 122 (25), 6491-6502 2018.
2) M. Shoji, T. Murakawa, et al., “Molecular mechanism of a large conformational change of the quinone cofactor in the semiquinone intermediate of bacterial copper amine oxidase”, Chem Sci, 13(36), 10923-10938, 2022.
3) M. Shoji, K. Kitazawa, et al., “Enantiomeric Excesses of Aminonitrile Precursors Determine the Homochirality of Amino Acids”, JPCL, 14(13), 3243-3248, 2023.
■良く使用するプログラム・装置
1) 量子化学計算プログラム(Gaussian)
2) Python
3) スパコン( 筑波大Cygnus, 富嶽)
 R6年度分野別専門委員
R6年度分野別専門委員
筑波大学・計算科学研究センター
庄司光男 (しょうじみつお)
https://www2.ccs.tsukuba.ac.jp/people/mshoji
「分子軌道法で求めた薬分子の電子状態からその薬効を考える」
■背景 生物物理学で取り扱う現象の多くは、分子の電子状態が生体内で起こる反応を支配しています。分子軌道法を使うと、分子の電子状態が見えてきます。今日では、windowsのPCなどでもソフトを利用すると手軽に非経験的分子軌道法や半経験的分子軌道法の計算ができるようになりました。また現在でも様々な計算手法が開発されています。これらの計算方法で計算された電子状態は、実験のデータが再現できたり、実験では見ることが出来ない世界を我々に教えてくれたりします。生物物理では実験と理論の両輪で研究が進んでいますが、その理論側を支える一手法が分子軌道法です。
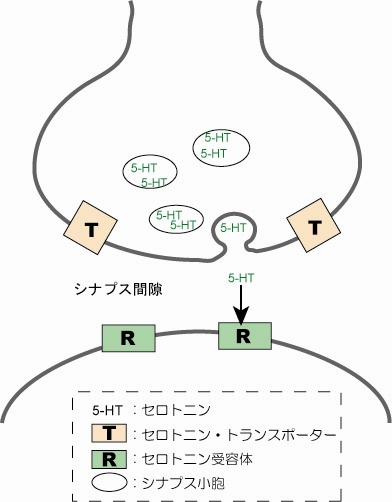
図1 シナプス間隙中において、シナプス前ニューロンから放出された神経伝達物質セロトニン(図中5-HT)が後ニューロンにあるセロトニン受容体(図中R)へ到達する様子。「うつ病」状態では、シナプス間隙中のセロトニン濃度が低くなっていてセロトニンの作用が起こりにくくなっていると考えられています。
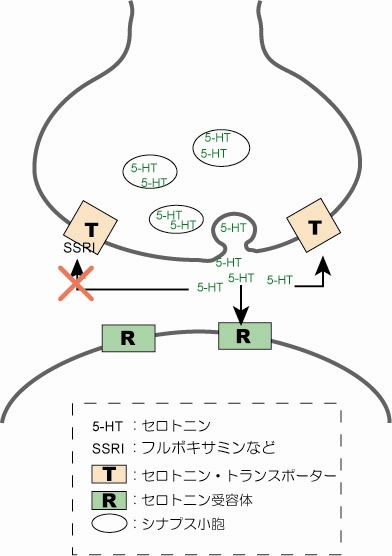
図2 SSRI分子は、シナプス前ニューロン中のセロトニントランスポーター(図中T)に作用してセロトニンの再取り込みを阻害します。それで、シナプス間隙中のセロトニン(図中5-HT)の濃度を増やします。
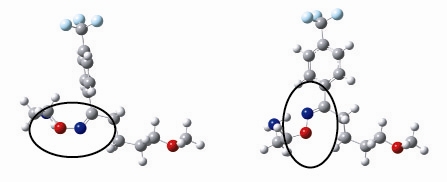
図3 フルボキサミン分子の構造(シス型(左)とトランス型(右))。図中の〇で示した部分がC=N結合です。薬効があるのはトランス型のもののみです。
図4 分子の構造の違いで、SERTに認識される?認識されない?が決まるようなので、受け皿側(SERT)の構造の様子がわかるかも。
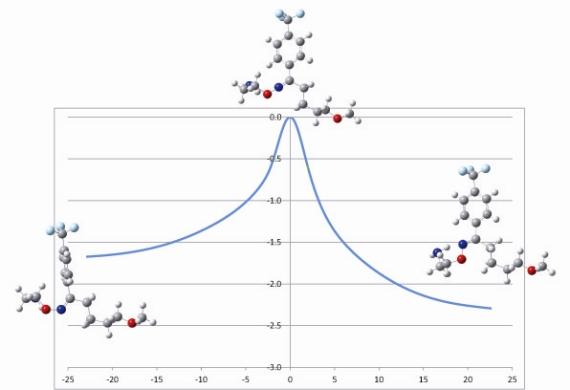
図5 フルボキサミンの異性化過程を表す反応座標。縦軸は[eV]というエネルギーの単位です。
■研究概要
今回紹介する研究は、うつ病の薬を計算対象にしたものです。
では、最初に分子レベルで「うつ病」を見てみましょう。「うつ病」状態では、脳にある神経のシナプス間隙中でセロトニン濃度が低くなっているため、神経末端にあるセロトニン受容体へセロトニンの作用が起こりにくくなっています(図1)。現在、この図中のセロトニン受容体やセロトニントランスポーター(SERT)というタンパク質の構造は詳しくわかっていませんが、それらを標的にした何種類かの薬は開発されています。今回取り上げるのは、選択的セロトニン再取り込み阻害薬(Selective Serotonin Reuptake Inhibitors:SSRI)と呼ばれる薬(抗うつ病の薬としては第3世代)の一種フルボキサミンです。この分子は、シナプス前ニューロン中のセロトニントランスポーター(SERT)に選択的に作用することで、セロトニンの再取り込みを阻害します(図2)。それにより、シナプス間隙中のセロトニン濃度を高くして「うつ状態」を解消するのです。
実は、この薬(分子)は分子中のC=N結合部分(図3)がトランス型なのですが、光をあてると薬効の無いシス型が生成することが分かっています(参考文献1)。分子の構造の違いで、SERTに認識される・認識されないが決まります(図4)。このフルボキサミン分子の構造の違いやセロトニン分子の構造から、まだ実験で見ることが出来ていないSERTの認識部位(薬の分子が結合する部分)の構造が推測できるのではないか?というのがこの研究の大きな目的です。
現在我々が分子軌道法で明らかにできているのは、フルボキサミンの異性化過程です。このことについて、紹介します(図5)。分子軌道法を使うと、このように分子が変形(異性化)するときの道筋やエネルギーの変化を見積もることが出来ます。このエネルギー図からは光をあてないと分子の変形は起こらなさそうだということが分かります。その他にも、実験で求められているNMR値(参考文献2)を分子軌道法で再現することから、フルボキサミン分子の構造が理論的に特定出来ています。
なぜ、分子の形が違うと薬として働かなくなるの?と言う疑問についての研究はまだ継続中です。
■科学的・社会的意義 厚生労働省の3年ごとの調査報告で、うつ病総患者数は1999年に44.1万人、2008年には104.1万人と約10年間で2倍以上に増加しています。日本では、10~15人に一人が「うつ病」を経験すると言われているようです。また、セロトニントランスポーター(SERT)は、その遺伝子変異が自閉症の発症や性格形成に関連しているという報告があり、近年注目されています。生物物理学に限らず様々な分野からSERTの機能調節の仕組みを明らかにしていくことは、新しい治療法の開発につながると考えられます。ヒトのSERTの結晶構造が得られていない現在、治療効果が期待される新たな阻害薬の開発に活用できそうな知見を、理論的な本研究により示したいと思っています。
■参考文献
(1)Miolo, G., et al. (2002) "Photoisomerization of fluvoxamine generates an isomer that has reduced activity on the 5-hydroxytryptamine transporter and does not affect cell proliferation" European Journal of Pharmacology 450 (3):223-229
(2)Deubner, R., Holzgrabe, U.(2002)" Quantitative 1H NMR spectroscopic determination of the E/Z isomer ratio of the antidepressant drug fluvoxamine for use in pharmaceutical analysis" Magn. Reson. Chem. 40:762-766
■良く使用する材料・機器
1) gaussian09(Gaussian, Inc.)https://www.gaussian.com/
2) MOPAC https://openmopac.net/MOPAC2012.html
 H24年度分野別専門委員
H24年度分野別専門委員
湘北短期大学・情報メディア学科
小田井 圭(おだい けい)
