紫外・可視・蛍光・CD
「光は万能ツール!〜まだ見ぬ世界を照らすさまざまな光〜」
■背景
光は,いつも私たちのまわりにあふれています。光があるおかげで,私たちは,明るさ・暗さ,色,その他にもいろいろな情報を得ることができます。思い返してみてください。暗い夜道を歩くとき。歩く先を懐中電灯の光で照らせば,そこには,何が,どのような大きさのものが,どのような形のものが,どのくらい,どのように置かれているかがわかります。
光は,私たちの日常生活だけではなく,宇宙や生命の謎を解き明かそうとする最先端の科学研究にも,さまざまな用途で使われています。暗い夜道を照らすように,私たち科学者はさまざまな光を使って,まだ誰も知らない世界を見よう,理解しようとしています。ここでは,『紫外・可視・蛍光・CD』 というある物理的な特徴をもつ光を使った研究例を紹介します。
■研究概要
(1)紫外・可視:
光には,波のようにある周期的な長さをもって空間を伝わっていく性質があります。この周期的な波の長さのことを波長とよび,ナノメートル(nm:10億分の1メートル)という単位であらわします。図1に示すように,紫外・可視は,波長の違いによって分類された光のことです。一般に,100 〜 400 nmの光を紫外光(または紫外線),400 〜 750 nmの光を可視光(または可視光線)とよびます。ちなみに,可視光は私たちの目で見ることができる光で,波長の長い方から順に,赤・橙・黄・緑・青・藍・紫の各色に見えます。
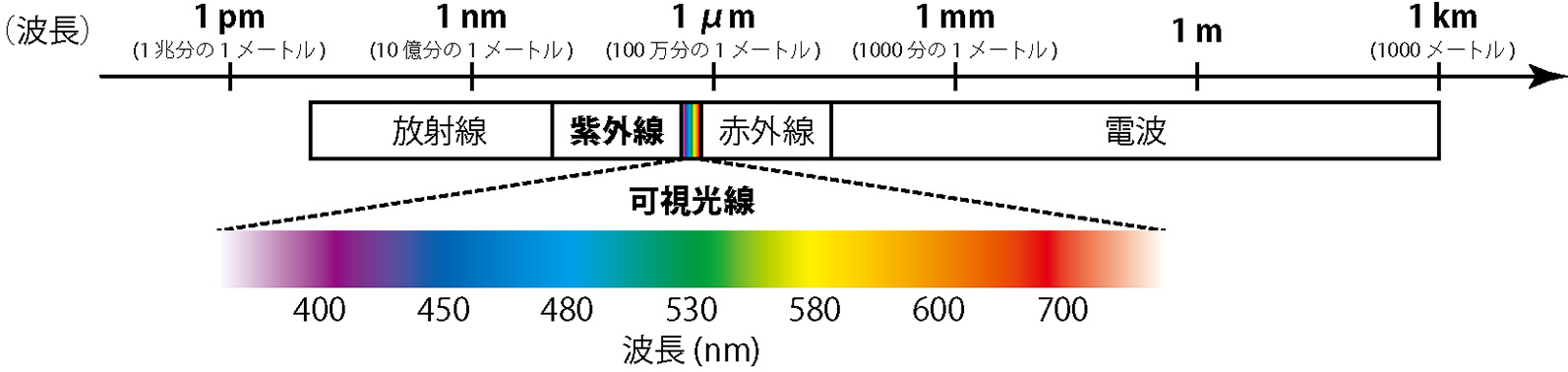
図1 波長の違いによって分類されている光。
図2Aに示したグラフは,温泉にすんでいる微生物がもっているサーモフィリックロドプシンというタンパク質の紫外・可視吸収スペクトルです。このタンパク質が,紫外から可視にわたる光をどのくらい吸収するのかを意味しています。吸収の大きさは光を吸収する物質の濃度に比例するので,この吸収スペクトルから試料に含まれるタンパク質の濃度を見積もることができます。図2Aには,2つの山(ピーク)があることがわかります。ひとつは,280 nm付近にある紫外光の吸収ピークで,これは主にタンパク質を構成するアミノ酸のうち,トリプトファン,チロシン,フェニルアラニンとよばれる芳香環をもつアミノ酸に由来する吸収です。もうひとつは,530 nm付近にある緑色の可視光の吸収ピークで,これはロドプシンに含まれるレチナールという色素(図2B)に由来する吸収です。サーモフィリックロドプシンは緑色の光をよく吸収するので,見た目には緑色の反対色にあたるピンク〜赤色に見えます。
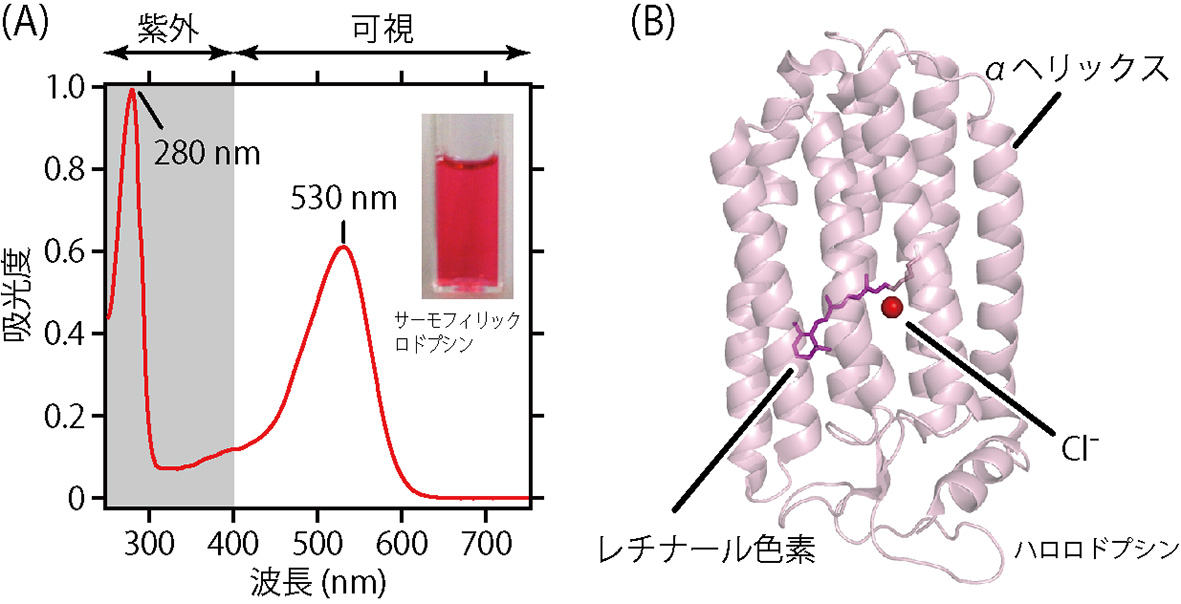
図2 紫外・可視吸収スペクトルの利用①。(A)サーモフィリックロドプシンの吸収スペクトル。緑色光を吸収するので,水溶液は反対色のピンク〜赤色に見える。(B)ロドプシンの分子構造(ハロロドプシン,PDB ID:3A7K)。黄色で示した分子が,光を吸収するレチナールという色素。
ロドプシンは,基質となるイオンの濃度を変化させることによって,可視光の吸収ピークが移動する,すなわち色が変わることが知られています。この変化を紫外・可視吸収スペクトル測定で追跡することによって,水素イオンを含む基質イオンの親和性(解離定数(Kd)という物理量であらわします。水素イオンの場合は特別に,酸解離定数(pKa)といいます)を見積もることができます。図3には,塩化物イオン(Cl-)を基質とするハロロドプシンの紫外・可視吸収スペクトルを示しました。ハロロドプシンは,塩化物イオンの濃度が低い時は600 nmの赤色の光をもっともよく吸収するため,見た目には青色に見えます。塩化物イオンの濃度が高くなってくると,可視光の吸収ピークが左側に移動し,20 nmだけ波長の短い580 nmのオレンジ色の光をもっともよく吸収するようになります。このとき,見た目には紫色に見えるようになります。
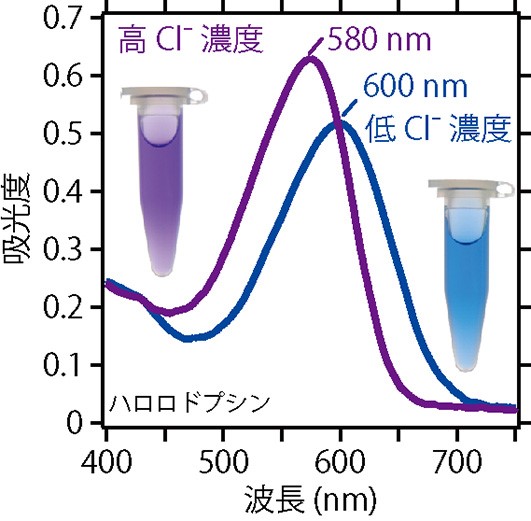
図3 紫外・可視吸収スペクトルの利用②。ハロロドプシンの吸収スペクトルと塩化物イオンの濃度の違いによる水溶液の色の変化。
加えた塩化物イオンの濃度と,吸収の変化量の関係をあらわしたのが図4です。変化の中点にあたる塩化物イオンの濃度が,解離定数Kdとなります。ハロロドプシンの場合は,およそ1 mM(Mはモル濃度mol/Lのことです)です。ハロロドプシンは,およそ1 mMの解離定数で図2Bに示す領域に塩化物イオンを結合し,光に応答してこの塩化物イオンを輸送する機能を発揮します。塩化物イオンが輸送されることによって,生体エネルギー分子であるアデノシン三リン酸(ATP)の生産に間接的に関与すると考えられています。
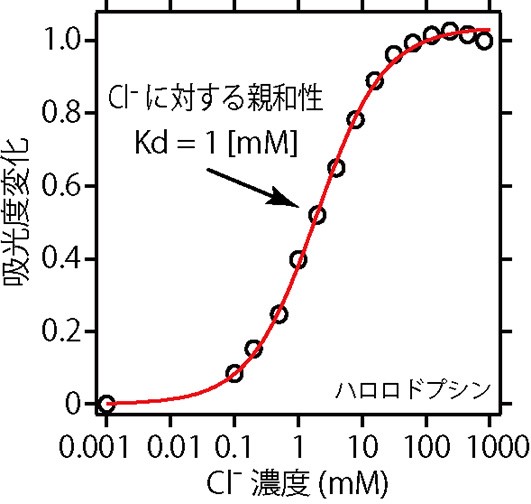
図4 紫外・可視吸収スペクトルの利用③。ハロロドプシンの塩化物イオンに対する親和性(解離定数:Kd)は,およそ1 mM。
(2)蛍光:
蛍光は,『蛍光灯』や『蛍光ペン』などで耳なじみのある言葉です。物質には,外から加えられたエネルギーを吸収して,それと同じだけのエネルギーを光に変えて放出するものがあります。この現象を発光と呼びます。蛍光は発光現象のひとつで,紫外光や可視光のエネルギーを吸収して発光する光のことです。蛍光を使った分析は,とても感度が良いことが特徴です。たとえ小さな光でも,真っ暗闇にポツンと光れば何かがあることがわかるように,蛍光を使うと分析する試料の量が少なくても,そこに何がどれだけあるのかを知ることができます。細胞の中にわずかに含まれている分子の挙動やイオンの濃度変化を,蛍光を使って観察する方法は,生命科学の最先端の方法でもあります。また,蛍光を発するものの周囲の状態が変化することによって,蛍光が強くなったり弱くなったり,蛍光の色(波長)が変化する性質があります。蛍光は,分析する試料がどのような環境に置かれているのかを調べることにも使われています。
(3)CD:
CDはcircular dichroismの頭文字表記で,日本語では円二色性と呼びます。CDには,偏光という光の性質が関係しています。(1)で述べたように,光は波の性質を持っています。水面を伝わる波が上下に振動しながら伝わっていくように,光もまた振動しながら空間を伝わっていきますが,光の場合は360°すべての方向に振動します。偏光は,規則的な振動方向をもつ光のことで,直線偏光と円偏光という種類があります。図5Aのように,振動が一方向にそろった偏光を直線偏光と呼びます。また,図5Bのように,振動が回転し,ぐるぐると渦を巻くように伝わる偏光を円偏光と呼びます。円偏光には,右向きと左向きがあり,同じ強さの左右の円偏光が重なると直線偏光になり,異なる強さの左右の円偏光が重なると楕円偏光になる,という性質があります(図5C)。
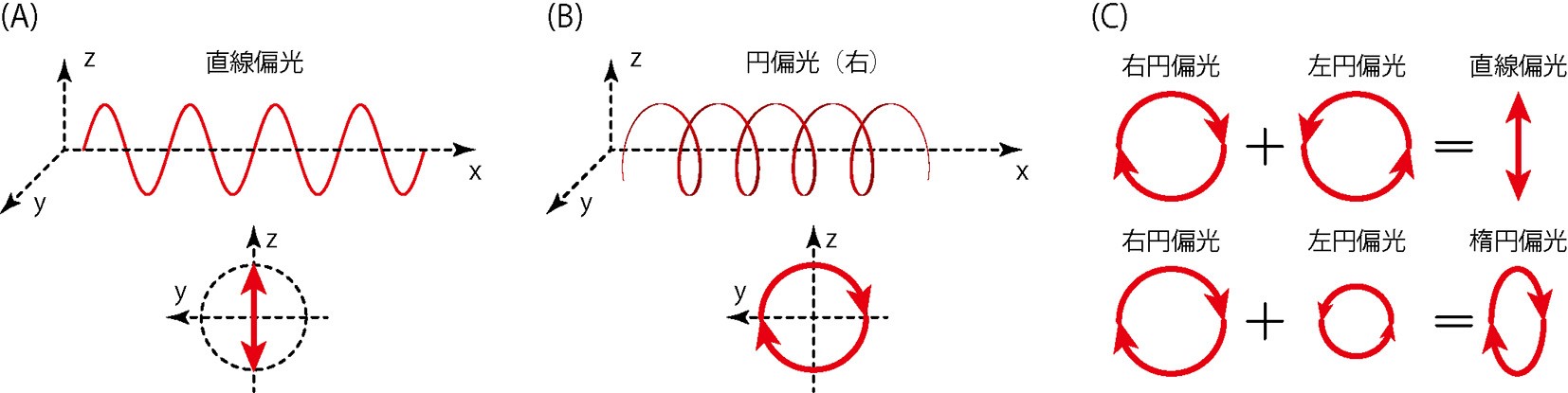
図5 偏光の性質。(A)直線偏光。(B)円偏光。(C)強度が同じ円偏光が重なると直線偏光となり,強度が異なると楕円偏光になる。
物質には,左右の円偏光のどちらかをよく吸収する性質をもつものがあり,光学活性があるといいます。CDでは,光学活性のある物質のもっている左右円偏光の吸収の大きさを測定して,その物質の構造を調べることができます。また,どのような構造を知りたいかによって,紫外や可視の偏光を利用します。例えば,タンパク質の場合,αヘリックス(図2B)やβストランドと呼ばれる規則的な部分構造(二次構造といいます)を調べるときには,180 – 250 nmの遠紫外領域にある偏光を使います。この領域には,アミノ酸どうしが結合してできるアミド結合に由来するCDが現れます。図6は,ハロロドプシンの遠紫外CDスペクトルです。アルファベットの『W』の形をしたグラフの形は,ハロロドプシンのようにαヘリックスをもつタンパク質に特徴的に見られるものです。遠紫外CDの場合,グラフの形と吸収の強度を使って,タンパク質中の二次構造の量を計算することができます。ですから,まだ構造のわからないタンパク質であっても,遠紫外CDを測れば,αヘリックスやβストランドを何パーセントずつもっているのかを計算で見積もることができます。
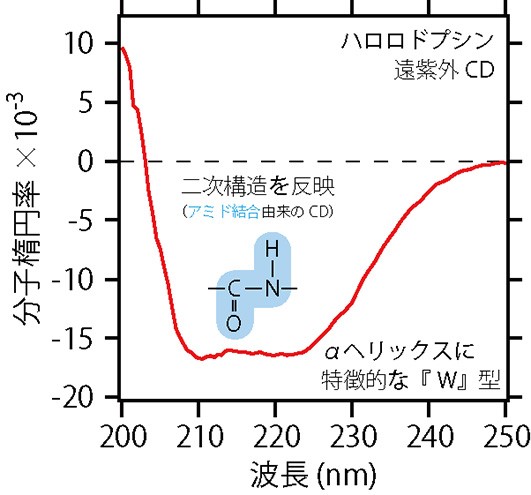
図6 CDスペクトルの利用①。ハロロドプシンの遠紫外CDスペクトル。二次構造を反映する。
タンパク質の立体的な折りたたみ構造(三次構造といいます)を調べるときには,250 – 300 nmの近紫外領域にある偏光を使います。図7は,ハロロドプシンの近紫外CDスペクトルです。この領域には,(1)にも登場した芳香族アミノ酸のうち,トリプトファンに由来するCDが現れます。タンパク質が三次構造をつくるとき,トリプトファンはタンパク質の内側に折りたたまれることが多くあります。このとき,別のトリプトファンが近くにあれば,トリプトファンどうしの相互作用によって,特徴的な光学活性が生まれます。これによって,タンパク質が正しく三次構造を作っているかどうかを評価することができます。
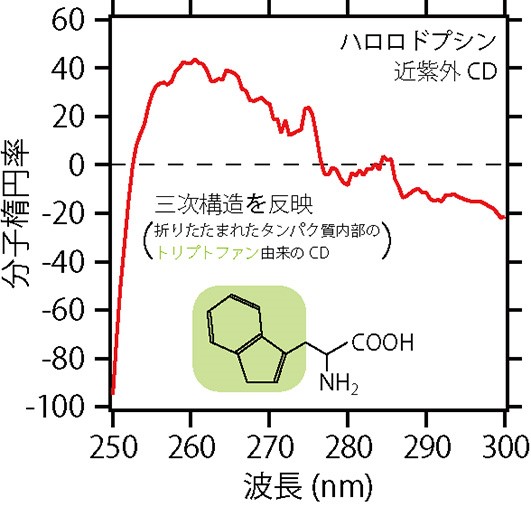
図7 CDスペクトルの利用②。ハロロドプシンの近紫外CDスペクトル。三次構造を反映する。
可視吸収のある光学活性物質は,可視の偏光を使って調べます。図8は,ハロロドプシンの可視CDスペクトルです。ロドプシンにはレチナールが入っているので,可視のCDがあらわれます。ロドプシンには,多量体を形成するものが知られています。その場合,可視CDスペクトルには,レチナール分子間の相互作用(双極子モーメント)による1組の正負のCDがあらわれ,横軸との交点が可視光の吸収ピークとほぼ重なります。ハロロドプシンの場合は,545 nmと605 nmにそれぞれ正負のCDがあり,可視吸収のピークである580 nmで横軸と重なっています。ロドプシンの可視CDは,強度が異なっていたり,正負のピークの出現パターンが逆になっていたりする場合(図8,図9の赤いスペクトル)があり,定量的な理解はまだ難しい状況です。タンパク質の立体構造解析や,ほかの分析手法とあわせて解釈する必要があります。

図8 CDスペクトルの利用③。ハロロドプシンの可視CDスペクトル。多量体構造を反映する。
可視光の領域は紫外光よりも光の散乱が少ないため,試料の状態を工夫すると新しいことがわかります。図9は,シアノバクテリア由来のグロエオバクターロドプシンの可視CDスペクトルです。青で示したスペクトルは,大腸菌の細胞膜に埋まった状態のグロエオバクターロドプシンのものです。赤で描かれた水溶液中のCDスペクトルと同じ特徴が見られており,グロエオバクターロドプシンが細胞膜中でも多量体を形成していることがわかります。
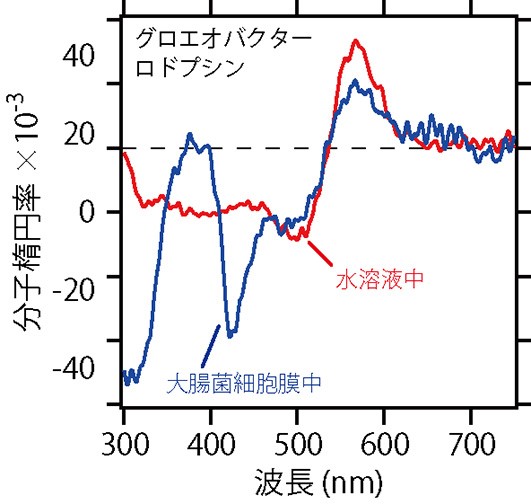
図9 CDスペクトルの利用④。グロエオバクターロドプシンの可視CDスペクトル。赤:水溶液中,青:大腸菌細胞膜中のグロエオバクターロドプシン。
■科学的・社会的意義 光を使った分析方法は,さまざまな分野で広く使われています。同時に,理論と技術の発展によって日々進化し続けています。たとえば,光を使って細胞や動物個体の行動を制御する,光遺伝学(オプトジェネティクス)という分野が誕生し,神経や脳がどのように活動しているのかを観察できるようになりました。今後,5年後,10年後,50年後,あるいはその先には,今はまだ暗くて見えない道であっても,それを明るく照らす光が必ずあらわれて,今よりももっとたくさんのことがわかり,豊かな社会に発展してくと信じています。
■参考文献
1)Tsukamoto, T., Inoue, K., et al. (2013). "Thermal and Spectroscopic Characterization of a Proton-Pumping Rhodopsin from an Extreme Thermophile." J Biol Chem 288 (30): 21581-21592.
2)Tsukamoto, T., Demura, M., et al. (2014). "Irreversible Trimer to Monomer Transition of Thermophilic Rhodopsin upon Thermal Stimulation." J Phys Chem B 118: 12383-12394.
3)塚本卓,須藤雄気. (2015). "好熱性細菌のレチナールタンパク質." 生物物理 55 (2): 92-94.
4)Sato, M., Kanamori, T., et al. (2002). "Stopped-Flow Analysis on Anion Binding to Blue-Form Halorhodopsin from Natronobacterium pharaonis: Comparison with the Anion-Uptake Process during the Photocycle." Biochemistry 41 (7): 2452-2458.
5)Matsuno-Yagi, A., and Mukohata, Y. (1980). "ATP Synthesis Linked to Light-Dependent Proton Uptake in a Red Mutant Strain of Halobacterium Lacking Bacteriorhodopsin." Arch Biochem Biophys 199 (1): 297-303.
6)Kouyama, T., Kanada, S., et al. (2010). "Crystal Structure of the Light-Driven Chloride Pump Halorhodopsin from Natronomonas pharaonis." J Mol Biol 396 (3): 564-579.
7)Tsukamoto, T., Sasaki, T., et al. (2012). "Homotrimer Formation and Dissociation of pharaonis Halorhodopsin in Detergent System." Biophys J 102 (12): 2906-2915.
8)Tsukamoto, T., Kikukawa, T., et al. (2013). "Salt Bridge in the Conserved His-Asp Cluster in Gloeobacter Rhodopsin Contributes to the Trimer Formation." FEBS Lett 587 (4): 322-327.
9)日本分光学会編. (2009). "分光測定入門シリーズ5 可視・紫外分光法" 講談社.
10)浜口浩三,武貞啓子 (1971). "生物化学実験法6 蛋白質の旋光性:ORDとCD" 学会出版センター.
11)Berova, N., Nakanishi, K., Woody W.R. (2000). "Circular Dichroism: Principles and Applications, 2nd Edition." Wiley-VCH.
12)神取秀樹 他 (2013). "オプトジェネティクス 〜光工学と遺伝子による行動制御技術の最前線〜" (株)エヌ・ティー・エス.
■良く使用する材料・機器
1) 紫外・可視分光光度計UV-1800,UV-2450(積分球つき)(株式会社 島津製作所)
2) 円二色性分散計J-725(日本分光株式会社)
3) 蛍光分光光度計F-2000 (株式会社 日立ハイテクノロジーズ)
4) 界面活性剤 (株式会社 同仁化学研究所)
5) 実験試薬 (和光純薬工業株式会社,シグマアルドリッチジャパン 他)
 H27年度分野別専門委員
H27年度分野別専門委員
岡山大学大学院医歯薬学総合研究科・生体物理化学
塚本 卓(つかもと たかし)
https://www.pharm.okayama-u.ac.jp/lab/bukka/index.html
