生物発光
「光をシグナルとするセンシング:光る生物はなぜ光るのか」
■背景
人類は遥かな昔から光る生物に関心を示してきました。たとえばアリストテレスが海洋生物の光について記録しています。またコロンブスは航海日誌にMilky Seaについて記述しています。光るメカニズムは?光る目的は?など、生物発光は不思議の宝庫であり、多くの科学者の探究心を高めてきました。科学的探究心の結晶であるGFPに象徴されるように、生物発光および関連遺伝子・タンパク質は実用の観点からもアトラクティブです。
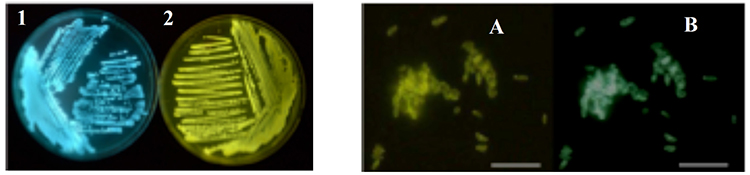
図1 発光細菌の光の色の多様性(左)および発光細菌2の生細胞蛍光画像(右).
1, Photobacterium phosphoreum bmFP; 2, Aliivibrio sifiae Y1(Vibrio fischeri Y1).A, レドックス性黄色蛍光タンパク質(Y1-Yellow [Y1-YFP]より改名)に基づく画像;B, 主にルシフェラーゼ反応生成物によると考えられる画像(bar=10 µm)(文献 1).光の色の多様性はルシフェラーゼ反応への内在性蛍光タンパク質の関与によって生じます.
■研究概要
発光細菌の光を酸素呼吸とのカップリングに着目して調べた結果、呼吸鎖電子伝達系と生物発光が分子レベルでリンクしていること、また一部の発光細菌に関して、生物発光の色が呼吸鎖近傍のレドックス状態に依存することがわかりました(図2)。他方、実用化を念頭に置いて、Y1-Yellowコード遺伝子(Y1-Yellow)による酵母ミトコンドリア(MT)ROSの生細胞可視化を行いました(図3 文献2)。
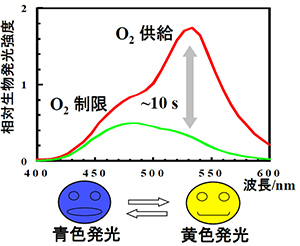
図2 A. sifiae Y1変調生物発光スペクトル.黄色発光(O2供給)⇄青色発光(O2制限):生物発光色の可逆的な変化.

図3 MT-Y1-Yellow形質転換酵母MTの蛍光可視化.A,分散したMT(矢印);B,高濃度ROS存在下集合したMT(破線内)(Aと異なるプレパラート)(赤い輪郭,トリパンブルーによる).
これまでの研究からはまた、生物発光や関連蛍光タンパク質の蛍光をシグナルとして、酸化的リン酸化過程の副産物でもある活性酸素種(ROS)のセンシングに利用できることがわかってきました。現在、独自の発光関連遺伝子をベースとした細胞毒性や生態系の環境毒性を生物発光と関連蛍光に基づいて評価する手法の確立を目指しています。手法の基礎的なコンセプトを図4に示します。
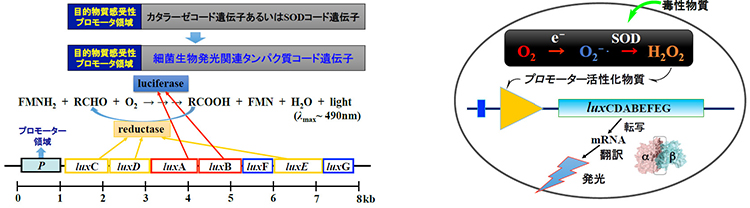
図4 目的物質感受性細菌生物発光コード遺伝子(左)およびROS感受性生物発光大腸菌(右).lux遺伝子は図1のP. phosphoreum bmFPから得ました.ROSなどの目的物質に応答して発光するシステムについては20年以上前から先行研究例があります.
■科学的・社会的意義 発光−呼吸間カップリングメカニズムを詳しく解明することにより、なぜ光るの?を細胞レベルから説明するための科学的根拠の獲得に繋がるものと期待しています。また、細胞毒性や環境毒性を対象とした生物発光・蛍光発光センシング法を好適に構築できれば、生命科学、環境科学など多様な分野において貢献できるものと期待しています。
■参考文献
1) H. Karatani, S. Matsumoto, K. Miyata, S. Yoshizawa, Y. Suhama, S. Hirayama. Bioluminescence color modulation of P. Vibrio fischeri strain Y1 coupled with alterable level of endogenous yellow fluorescent protein and its fluorescence imaging. Photochem. Photobiol., 82, 587-59 (2006).
2) H. Karatani, Y. Namikawa, N. Mori, Y. Nishikawa, S. Imai, Y. Ihara, A. Kinoshita, K. Kitadokoro, H. Oyama:Visualization of mitochondria in living cells with genetically encoded yellow fluorescent protein originating from a yellow-emitting luminous bacterium, Photochem. Photobiol. Sci., 12, 944-956 (2013).
■良く使用する材料・機器
1) 各種スペクトロメーター
2) 蛍光顕微鏡・実体顕微鏡
3) 自家製生物発光時間過程測定装置
 H27年度分野別専門委員
H27年度分野別専門委員
京都工芸繊維大学・分子化学系・生物物理化学研究室
柄谷 肇(からたに はじめ)
「生物発光研究の過去・現在・未来」
Q1: 生物発光研究の歴史を教えてください。 A1: 源氏物語にもホタルの描写があるように[1]、古来人々の素朴な興味を惹きつけてきました。本格的な研究は米国のHarveyに始まるここ100年ぐらいですが[2]、それよりも以前1670年頃に「ボイルの法則」で有名なBoyleが既に朽木の発光に空気(酸素)が必要なことを発見しています[3]。今日よく知られたルシフェリン-ルシフェラーゼ(L-L)反応は、フランスのDuboisが発光昆虫ヒカリコメツキの発光組織をすり潰した懸濁液を光らなくなるまで放置した成分(酵素;ルシフェラーゼ(Luc)と呼ぶ)と熱水抽出成分(基質;ルシフェリン(Ln)と呼ぶ)とを混合すると発光することが発見の端緒と考えられます[4]。今日ではL-L反応を示す発光生物は多く見出されていますが、異なる発光生物同士では勿論ルシフェリンもルシフェラーゼも異なります。図1にゲンジボタルのルシフェリンの分子構造とルシフェラーゼの立体構造[5]を示しておきます。
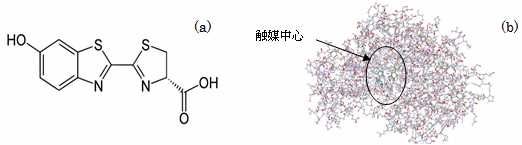
図1ゲンジボタルの(a)ルシフェリンの分子構造と(b)ルシフェラーゼの立体構造。但し、AMPは水色、生成されるオキシルシフェリンを黄緑色で示した。なお、X線構造データから配位している水分子は取り除き、また、欠失原子の補正は行ったが、水素原子は付加していない。
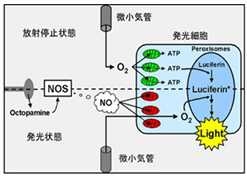 図2 酸素がミトコンドリア(緑)に取り込まれてATPが生成され、ペルオキシソーム中でルシフェリンと結合しルシフェリルアデニレート中間体ができる。次にNOS(一酸化窒素シンターゼ)により産生されるNO(一酸化窒素)がミトコンドリア(赤)を阻害し、酸素がペルオキシソームに達することで発光反応が生じるとする“発光明滅モデル”。 |
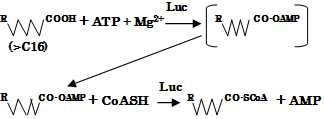 図3 ホタルルシフェラーゼ(Luc)が長鎖脂肪酸(C>16) アシルCoAシンセターゼとして作用する酵素反応式。ただし、中間体として、アデニレート化合物が生成されると考える。 |
Q2: 生物が発光する目的は何ですか? A2: 難しい質問ですね。ただ、同じ系統の生き物がすべて光るわけではなく合目的に進化したとは考えられません。また、生理学的な意義として細胞傷害性のある活性酸素の消去反応であると唱える説もありますが、仮説の域を出ていません。むしろ、発光のパターン(リズム)や発光色に着目すると理解し易いでしょう。例えば、ホタルでは雌雄の相互認識による性フェロモンとしての役割が考えられます。また、海洋性の発光バクテリアは青白く光りますが、ちょうど海水中では太陽光の長波長成分がカットされ、青色より短波長の光が透過して発光バクテリアが背景色の中に隠れてしまう効果があります。
Q3: ホタルの明滅発光の仕組みを教えてください。そもそも発光の仕組みはどのように分子進化を遂げたのでしょうか? A3: 普遍的な発光モデルはないと思いますが、ホタルの発光にはATPが必須であり、その点に着目した研究があるので明滅のモデルと併せて紹介しておきましょう。まず図2を見て下さい。この図のポイントは発光細胞に供給されるO2がミトコンドリアにまず優先的に行渡りATPが産生され、その後NO(一酸化窒素)の作用でペルオキシソーム中にあるL-L反応系にO2が供給される時間差のために発光が明滅するというモデルです[6]。次に分子進化の問題ですが、そもそも発光現象は細胞内エネルギー代謝の問題と切り離せません。つまり、原始生物がエネルギーを獲得する体内反応から、突然変異的に発光反応が付与されたものと想像できます。Obaらはホタルのルシフェラーゼ自身が脂肪酸CoA合成酵素活性を合わせ持っていること(図3参照)を明らかにしました[7]。 その後、彼らは精力的に研究を重ね、光らない昆虫の脂肪酸CoA合成酵素のアミノ酸を1~3箇所変異させてルシフェラーゼ活性が現れることを実験で確かめていますが、この事実はバイファンクショナルな機能を持つ酵素の分子進化学の観点からも興味があります。
Q4:生物発光の研究は社会にどのように役立っているのでしょうか?また、今後どのような発展が期待されるのでしょうか? A4:明確な応用研究を当初から目的としない基礎研究の事例は枚挙に暇がありません。とは言え、今は研究成果が社会に還元されることが早急に求められる時代です。例えば、Shimomuraらの発光クラゲの研究によるGFP(Green Fluorescent Protein)の発見はノーベル賞の受賞対象となった業績ですが[8]、当初は医学への応用研究を目指したものではありません。レポ-タ-ジ-ンとして目的の生体組織にGFPの遺伝子を発現させて蛍光をモニタリングする技術が確立されたのは、1990年代以降のことです[9]。現在では、種々の発光生物から見出された発光関与物質が、微量分析技術等に欠かせない試薬として利用されています。最後に将来の展望ですが、まだ研究されていない発光生物が多く存在するので、従来の研究方法の延長線上に位置づけられるテーマとして、それらの発光分子機構を明らかにし応用技術へと導くことが挙げられます。あるいは、「エネルギ-変換」に着目すれば、筋肉の運動は「化学=>力学」エネルギ-変換、光合成は「光=>化学」エネルギ-変換と見なせるので、生物発光は「化学=>光」エネルギ-変換プロセスと捉える事が可能です。とすれば、その「反応の場」の要素を多元的に解析する方法論が考えられますが、これは生物物理の研究者には馴染みの考え方ではないでしょうか。このような新しい視点から“光”を当てる研究が生物発光の分野にも求められています。更に掘り下げて勉強をしたい人はShimomuraの著書[10]を読んで下さい。興味が惹き付けられる“知”の地平を切り開く新たなテーマに出会えるかもしれません。
[1] 源氏物語 第25帖、「蛍の巻」
[2] Harvey E.N. (1916) The mechanism of light production in animals. Science 44: 208-209
[3] Boyle R. (1668) Experiments concerning the relation between light and air in shining wood and fish. Phil Trans 2: 581-600.
[4] Dubois R. (1885) Note sur la physiologie des Pyrophores. Compt Rend Soc Biol 37: 559-562.
[5] Nakatsu T., Ichiyama S., Hiratake J., Saldanha A., Kobashi N., Sakata K. and Kato H. (2006) Structural basis for the spectral difference in luciferase bioluminescence. Nature 440, 372-376.
[6]Trimmer B.A., Aprille J.R., Dudzinski D.M., Lagace C.J., Lewis S.M., Michel T., Qazi S. and Zayas R.M.(2001) Ntric Oxide and the Control of Firefly Flashing. Science 292:2486-2488.
[7]Oba Y., Ojika M. and Inouye S. (2003) Firefly luciferase is a bifunctional enzyme:ATP-dependnt monooxygenase and a long chain fatty acyl-CoA synthetase. FEBS Letters 540:251-254.
[8] Shimomura O., Johnson F.H. and Saiga Y. (1962) Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol 59: 223-239.
[9] Chalfie M., Tu Y., Euskirchen G., Ward W. W. and Prasher D.C. (1994) Green fluorescent protein as a marker for gene expression. Science 263:802-805.
[10] Shimomura O. (2012) Bioluminescence-Chemical Principles and Methods (Rev. ed.) World Scientific, Singapore.
H25年度分野別専門委員
東洋大学・食環境科学部
和田 直久(わだ なおひさ)
https://www2.toyo.ac.jp/~bhwada/
