アロステリズム
「ヘモグロビンの臨機応変な酸素運搬機能」
■背景 私たちの体内には約10万種類の蛋白質が存在し、生命活動に必要な様々な機能を担っています。その中で、ヘモグロビンを代表とする一群の蛋白質は、環境の変化に合わせて自身の機能を迅速かつ適切に調節し、生命活動を支えています。アロステリズムとはこのような自己調節のことです。ヘモグロビンは、X線回折による結晶構造が初めて明らかになった蛋白質の一つであり、原子座標レベルの立体構造に基づく研究が昔から行われてきました。しかし、肝心のアロステリズムの仕組みについては、系の複雑さと方法論的な難しさがあり、あまり多くのことはわかっていません。
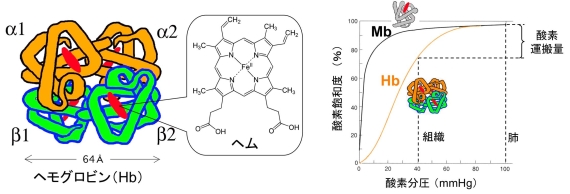
図1 ヘモグロビン(Hb)の模式図(左)と生理条件下のS字型酸素解離曲線(右)。筋肉中の酸素貯蔵蛋白質である単量体ミオグロビン(Mb)の酸素解離曲線との比較。
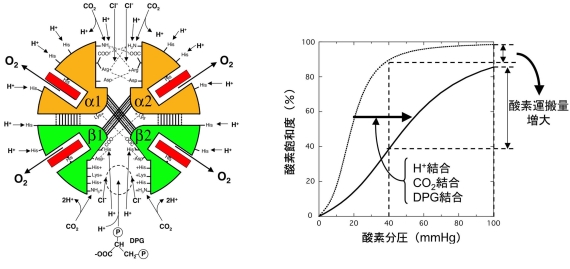
図2 生体内低分子の結合がヘモグロビンのO2解離を促す模式図(左)と、低分子の結合による酸素解離曲線の右方変位と酸素運搬量の増大(右)。
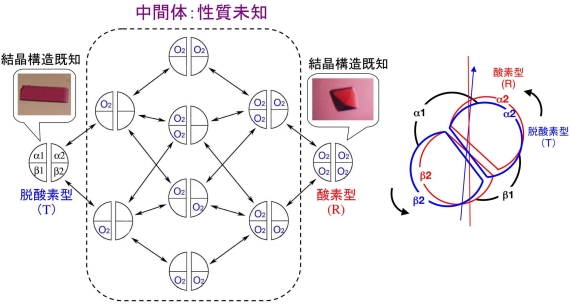
図3 ヘモグロビンの4段階酸素結合過程に現れる8種類の中間体と、よく調べられている両端の状態(TとR)。
■研究概要
ヒトのヘモグロビンは、2個のaTブユニットと2個のbTブユニットが会合した4量体からなり、各サブユニットに含まれるヘムのFe2+がO2を脱着します(図1左)。したがって、ヘモグロビン1分子あたり合計4個のO2を脱着しますが、その付き易さは一様ではなく、初めの方に付くO2が後から結合するO2を100倍以上も付き易くするヘム間相互作用(協同作用)が見られます。ヘモグロビンのヘム間相互作用はアロステリズムの典型として古くから注目されてきました。図1(右)にヘム間相互作用の生理的意義を示しました。黒色で示したヘム間相互作用のない単量体ミオグロビン(Mb)の双曲線型の酸素解離曲線に対し、オレンジ色で示したヘモグロビン(Hb)の酸素解離曲線は顕著なS字型になっています。両者のO2結合量は、O2濃度が高い肺ではほぼ同じですが、O2濃度の低い末梢組織で大きな差が出るため、ヘモグロビンの方がより多くのO2を末梢組織で解離することができます(これをMbがキャッチ)。更にヘモグロビンは、O2消費量の多い活発な組織に多く存在するH+やCO2 、赤血球中に存在する2,3-diphosphoglycerate(DPG)などの低分子を感知して、O2解離を促すアロステリズムも備えています(図2)。
ではどのようにして、ヘモグロビンはO2などの低分子が結合したことを同じ分子内の他の部位へ伝えているのでしょうか?一般に、ヘモグロビンのアロステリズムの仕組みは、O2の完全に解離した脱酸素型ヘモグロビンの結晶構造(“張りつめた”という意味のtenseの頭文字を取って“T”)とO2が4個全て結合した酸素型ヘモグロビンの結晶構造(“弛緩した”という意味のrelaxedの頭文字を取って“R”)の違いから推測されてきました。しかし、仕組みを理解する上で鍵となるO2が1~3個結合した中間体は通常の方法では単離できないため、O2が順次付き易くなっていく過程に関する知見は驚くほど貧弱で、その実体はよくわかっていません(図3)。我々はこの過程を直接研究するため、独自のヘモグロビン分子を用いたモデル系で中間体を単離、観測する方法を開発してきました(文献1)。また、ヘモグロビンにはTとR以外にも機能に大事な未知の状態があることを、多孔性ゲルにヘモグロビン分子を閉じ込めて構造変化を凍結する独自の方法で示しました(文献2)。現在、これらの方法を駆使して、ヘモグロビンの取りうる構造とその機能を包括的に調べると同時に、結晶中での機能解析(文献3)、動的構造解析、などの新しい研究領域の開拓を行っています。
■科学的・社会的意義 多数の生物のゲノムが丸ごと読まれる時代になって、蛋白質の立体構造変化と機能の関係の原理的な理解が以前にもまして求められています。ヘモグロビンのアロステリズムの実体解明はこのような目的で進められています。このような知見の蓄積は、人工的に蛋白質の機能を改変する際の設計指針となり、医学・工学への応用につながると期待されます。
■参考文献
1)Shibayama, N. Imai, K., Morimoto, H., and Saigo, S. (1995) "Oxygen equilibrium properties of nickel(II)-iron(II) hybrid hemoglobins cross-linked between 82β1 and 82β2 lysyl residues by bis(3,5-dibromosalicyl)fumarate: Determination of the first two-step microscopic Adair constants for human hemoglobin." Biochemistry 34: 4773-4780.
2)柴山修哉 (2010) “MWC2状態モデルはヘモグロビンのアロステリーといかに調和しうるか”人工血液 18(3), 102-109.
3)Shibayama, N., Sugiyama, K., and Park, S.-Y. (2011) Structures and oxygen affinities of crystalline human hemoglobin C (β6 Glu→Lys) in the R and R2 quaternary structures. J. Biol. Chem. 286, 33661-33668.
■良く使用する材料・機器
1)顕微分光光度計システム(Carl Zeiss)
2)実験試薬(和光純薬株式会社、関東化学株式会社)
3)紫外可視分光光度計・分光蛍光光度計・円二色性分散計(日本分光株式会社)
 H25年度分野別専門委員
H25年度分野別専門委員
自治医科大学・生物物理学部門
柴山 修哉 (しばやま なおや)
https://www.jichi.ac.jp/medicine/about/department/basic/
physiology/biophysics/index.html
