水・水和・溶液
「溶媒を通してイオン・タンパク質の振る舞いを調べる」
■背景
人間の体の約70%は水でできている事をご存知でしょうか?原初の生命は水中で生まれ進化を遂げてきましたが、それが全ての生物に水が含まれている理由なのかもしれません。言い換えると、生物を形作る様々なタンパク質などの生体分子は水中に存在する事で機能しています。多くのタンパク質は水がないと自身の構造は変化し、本来の機能を発揮できません。また逆に、タンパク質周囲の水は通常の水とは異なるダイナミクスを持つことが知られており、タンパク質と水はお互いに相互作用を及ぼし合っています。つまり、タンパク質の挙動を完全に明らかにするためには周囲の水の挙動も明らかにする必要があるのです。
物質が水に溶ける事を水和と呼び、溶けた物質の事を溶質といいます。水分子は酸素原子と水素原子で構成されており電荷の偏りが存在するため、特に溶質と接する水分子は静電的な相互作用が安定になるように再配向します。それに伴い、溶質から(1.5層目、)2層目の水分子も水素結合を形成しやすいように再配向します。水和とはこのような溶質周りにおける水分子の再配向過程の結果なのです。この再配向した水分子は通常の水分子とどれだけ特性が変わっているでしょうか?
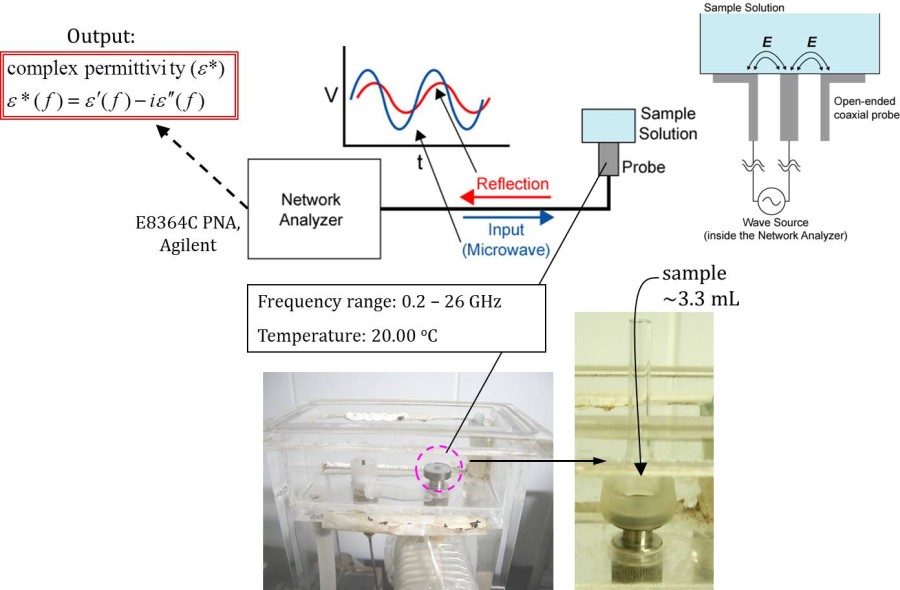
図1 誘電緩和分光法の模式図。ネットワークアナライザより入射されたマイクロ波はサンプルセル内で反射する。その際、サンプルの誘電特性に応じてマイクロ波の位相と振幅が変化するためそこから複素誘電率を求められる。
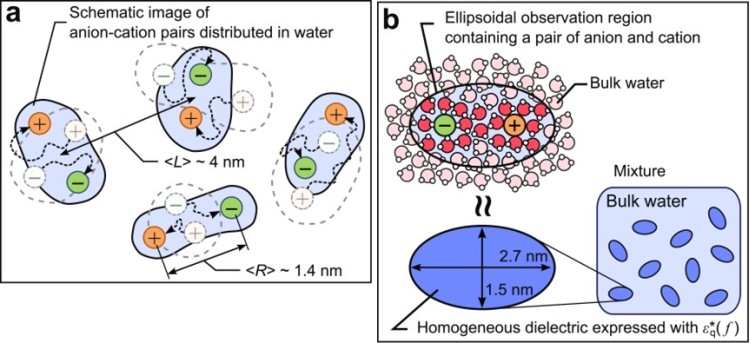
図2 1:1電解質水溶液のイメージ図。数値はイオン濃度が0.05 Mの時の平均値に相当する。(a)DRS測定の時間スケールではカチオンとアニオンは十分拡散しており様々な状態をとっているが、時間平均された測定値からはあるまとまった領域として観測される。(b)DRS観測領域とカチオンとアニオン及び水分子のイメージ。適用した回転楕円体の誘電体混合理論に用いた体積より、イオンから2-3層までの領域の水が1つの誘電緩和成分を構成していると考えられる。
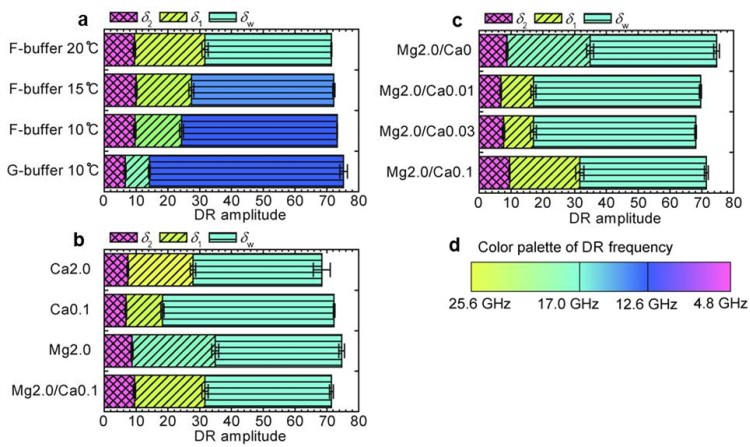
図3 アクチンの一定体積内の水和成分の内訳。各温度・バッファー条件における誘電緩和強度を示す。(a)F-buffer条件における温度依存性とGアクチンの比較。(b)Fアクチンの水和状態に及ぼす2価イオンの種類と濃度の効果。(c)Fアクチンの水和状態に及ぼすMg濃度一定条件におけるCa濃度の効果。(d)誘電緩和周波数のカラーパレット。(a)-(c)のそれぞれの成分の色に対応する。
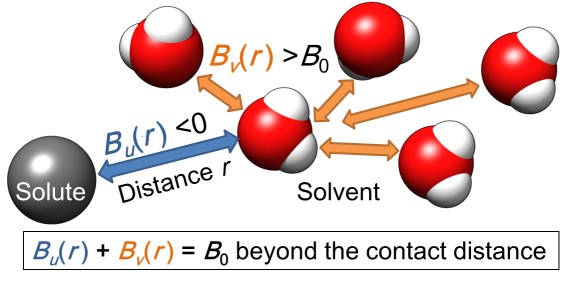
図4 溶質–水分子相互作用Bu(r)と水分子–水分子相互作用Bv(r)の模式図。単原子イオンの場合Bu(r)が負となり安定化を示し、それを打ち消すようにBv(r)が正となり不安定化を示す。この不安定化は水分子同士の電荷反発により説明できる。
■研究概要 水和を測定する手法にはX線や中性子線を用いた回折法などがよく用いられますが、溶質から遠く離れた水分子まで調べるためには誘電緩和分光法(Dielectric Relaxation Spectroscopy: DRS)が非常に優れています(図1)。タンパク質周囲の水和に関する研究は1888年にF. Hofmeisterが鶏卵白の主タンパク質リゾチームの沈殿具合が添加イオン種により異なるという発見に端を発します1)。イオン周囲の水和を理解する事がタンパク質の理解にもつながるため、私たちはDRSを用いて単純なイオンの水和を測定しました2)。その結果、希薄なイオン水溶液でも図2のようにカチオンとアニオンの緩いイオンペアが存在している事を示してきました。さらに、筋肉タンパク質であるアクチンにこのDRS測定・解析法を適用し、2価イオンによるアクチンの構造変化と水和状態の関係やCaイオンが数10マイクロMでもアクチンの構造に大きく影響する事などを明らかにしました3)(図3)。最近、水和が様々な反応にどのように寄与しているかを詳細に解明するために、分子動力学法(MD)を用いたエネルギー計算を行っています4)(図4)。このように実験と計算から、溶媒である水分子を調べる事でイオンやタンパク質の特性に迫っています。
■科学的・社会的意義 本研究は、タンパク質同士の相互作用における水和効果を取り入れた評価法につながると期待されます。また、この枠組みはあらゆる系に通ずるので幅広い分野で応用できるものと考えられます。
■参考文献
1)Hofmeister, F. Zur Lehre von der Wirkung der Salze, Arch. Exp. Pathol. Pharmakol. (Leipzig) 24, 247-260 (1888).; translated in Kunz, W., Henle, J. & Ninham, B. W. ' Zur Lehre von der Wirkung der Salze' (about the science of the effect of salts: Franz Hofmeister's historical papers,
Curr. Opin. Colloid Interface Sci. 9, 19-37 (2004).
2)Mogami, G., Miyazaki, T., Wazawa, T., Matubayasi, N. & Suzuki, M. Anion-Dependence of Fast Relaxation Component in Na-, K-Halide Solutions at Low Concentrations Measured by High-Resolution Microwave Dielectric Spectroscopy. J. Phys. Chem. A 117, 4851-4862 (2013).
3)Suzuki, M., Imao, A., Mogami, G., Chishima, R., Watanabe, T., Yamaguchi, T., Morimoto, N. & Wazawa, T. Strong Dependence of Hydration State of F-Actin on the Bound Mg2+/Ca2+ Ions. J. Phys. Chem. B 120, 6917-6928 (2016).
4)Mogami, G., Suzuki, M. & Matubayasi, N. Spatial-Decomposition Analysis of Energetics of Ionic Hydration. J. Phys. Chem. B 120, 1813-1821 (2016).
■良く使用する材料・機器
1)ネットワークアナライザPNA8364C(キーサイト・テクノロジーズ・インク)
2)密度計DMA5000M(アントンパール・ジャパン株式会社)
3)水冷静音サーバー RC Server Calm III 2000(リアルコンピューティング株式会社)
 H28年度分野別専門委員
H28年度分野別専門委員
東北大学大学院工学研究科・材料システム工学専攻
最上譲二 (もがみじょうじ)
「生命現象発現における水の役割を統計熱力学的に解明する」
■背景
生体内では、生体分子による種々の自己組織化や秩序構造形成が生命を支えています。それらの秩序構造は、高圧をかけると崩れます(例:蛋白質の圧力変性、F-アクチンのモノマーへの解離、アミロイド繊維の崩壊)。低温では構造形成力が弱まります(例:蛋白質の低温変性、ミオシンとF-アクチンの結合力の低下;非イオン性界面活性剤のミセルの平均サイズが約50℃から温度を下げると小さくなることとも関連)。これらの実験結果は、種々の過程の横断的共通性の存在を物語っており、「ある特定の因子」が支配的に効くことを示唆しています。その因子とは何でしょうか?

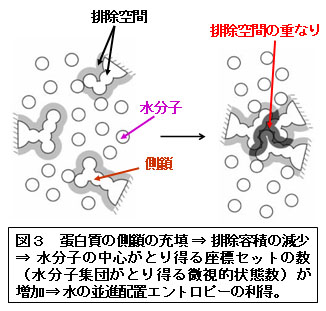
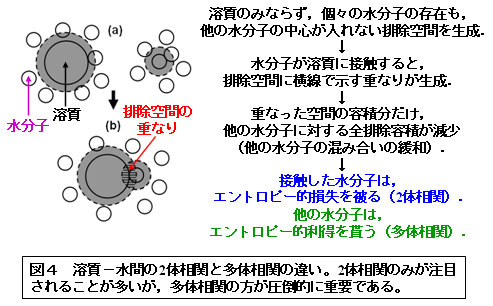

■研究概要 生体分子が自己組織化を起こすと、共存する水の並進配置エントロピーの利得が生じます(図1~3、文献1~3)。この利得は非常に大きく、アミノ酸残基数99のアポプラストシアニンの折り畳みを例にとりますと、常温における自由エネルギー低下に換算して-1700 kJ/molにも達します(文献1~3)。このエントロピー利得は、生体分子の構造エントロピー損失とエンタルピー変化(生体分子-水分子間の水素結合の切断を生体分子内または生体分子間の水素結合で必ずしも補償できないため、むしろ正になることが多い)の和を凌駕し、自己組織化の強力な推進力になります。上記の「ある特定の因子」は、水和エントロピーの生体分子-水分子間多体相関成分(図4、表1)であることが分かってきました。この因子を軸とした我々独自の理論により、以下の課題で成功を収めています(文献4~6):実験で観測されたアポプラストシアニンの折り畳みに伴う大きなエントロピー利得の定量的再現;蛋白質の低温変性・圧力変性のメカニズム;蛋白質の熱安定性の指標の提案;アミロイド線維形成のメカニズム;アクチンフィラメントに沿ったミオシンの一方向移動;シャペロニンによる蛋白質折り畳みの援助機能;F1-ATPaseにおけるγサブユニットの一方向回転;蛋白質立体構造予測に向けた自由エネルギー関数の開発;NMR実験に基づいて作成された蛋白質天然構造モデルのキャラクタリゼーション;蛋白質複合体におけるホットスポットの予測;分子認識のメカニズム;レセプターとリガンドの結合自由エネルギーの計算。一般に、荷電部位間の静電相互作用が強調されることが多いですが、塩(生体系では0.15M-NaCl)水溶液中では水分子およびカウンターイオン(特に後者)による遮蔽効果により,桁違いに弱くかつ短距離性になることに注意が必要です。
■科学的・社会的意義 生体系における種々の自己組織化やATP駆動蛋白質の機能発現のメカニズムを解明できるという基礎科学的意義を持ちます。従来の生体系の研究では欠落していた上記の「ある特定の因子」を水に対して分子モデルを採用して正しく計算し、これを主因子として他の因子を加え合わせることにより、生物物理学における多くの難問が解決できると期待されます。人工蛋白質の創製や高機能性生体材料の開発などのナノバイオテクノロジーの開拓、創薬過程の論理化や難病の新治療法の開発などの薬学・医学分野にも波及効果が期待できます。
■参考文献
1)木下正弘. (2008).「蛋白質の水和の熱力学量:分子性流体用積分方程式論と形態熱力学的アプローチの統合」,アンサンブル,10(3): 18-26.
2)Kinoshita, M. (2009). “Roles of Translational Motion of Water Molecules in Sustaining Life”, Front. Biosci., 14: 3419-3454.
3)Kinoshita, M. (2009). “Importance of Translational Entropy of Water in Biological Self-Assembly Processes like Protein Folding”, Int. J. Mol. Sci., 10(3): 1064-1080.
4)木下正弘,永山國昭. (2012).「タンパク質水和理論の新機軸Ⅰ.朝倉-大沢理論を越えて」,生物物理,52(4): 203-205.
5)木下正弘,永山國昭. (2012).「タンパク質水和理論の新機軸Ⅱ.新理論の応用展開」,生物物理,52(5): 250-253.
6)木下正弘,永山國昭. (2012).「タンパク質水和理論の新機軸Ⅲ.理論的考察」,生物物理,52(6)に掲載の予定.
■良く使用する理論的手段
1)3次元積分方程式論(溶媒=単純流体)
2)分子性流体用積分方程式論(溶媒=分子モデルを用いた水):分子間のポテンシャルと相関を分子の中心間距離および各々の分子の方向の多変数関数としてまともに扱う統計力学理論です。水分子の場合、その方向は、3つのオイラー角(双極子モーメントベクトルの天頂角と方位角および双極子モーメントベクトル周りの回転角)で表わされます。この理論を用いて計算した疎水性溶質の水和自由エネルギーは、計算機シミュレーションが与える値と良好に一致します。
3)形態熱力学的アプローチ(水中の生体高分子を原子レベルで扱う場合):複雑な形態を持つ溶質の溶媒和熱力学量を4個の幾何学的指標(排除容積Vex、露出表面積A、露出表面の平均曲率およびガウス曲率の積分値)の線形結合で表現します。溶媒和自由エネルギーの場合、溶質が十分大きくなるとVexの係数は圧力、Aの係数は平面壁における表面張力に収束します(large-solute limit)。蛋白質に対しては、large-solute limitは剛体球溶媒中では当てはまりますが、水中では当てはまりません。
 H24年度分野別専門委員
H24年度分野別専門委員
京都大学・エネルギー理工学研究所
木下正弘 (きのしたまさひろ)
https://www.iae.kyoto-u.ac.jp/centerbunya/kinoshita
