電子顕微鏡と生物物理
(2009/12/11)
ここでは、生物物理から見た、測定装置としての電子顕微鏡の魅力について、簡単に述べてみたいと思う。一般的には、電子顕微鏡を用いると、原子を直接可視化することができる。しかし、生体の生の構造を見ようと思うと、これは実現できない。生体試料に原子レベルの構造を見られるほどの電子を照射すると、試料は電子との相互作用により損傷を受けて、その構造は壊れてしまうからである。そこで、得たい分解能によって、様々な方法を用いて、損傷を回避しながらデータを収集することになる。ここでは、得たい分解能によって場合分けして、現状の電子顕微鏡を用いた生体高分子に適用可能な構造解析法を紹介し、どのようなデータが得られるのかを概観したい。
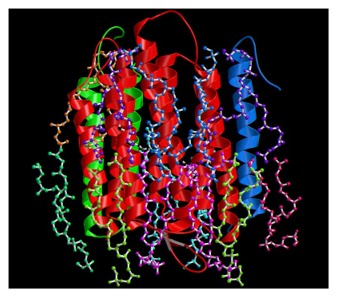 生体高分子の原子モデルが得られるような分解能での構造解析に用いられる最も一般的な方法としてX線結晶構造解析がある。しかし、X線結晶構造解析を適用するためには三次元結晶が必要である。一方、膜タンパク質などの場合には脂質二重層に局在しているので、天然に二次元結晶と言われる、膜状にタンパク質が規則正しく並ぶ場合があることが知られている。この二次元結晶を用いて電子線結晶構造解析により、X線結晶構造解析と同様に原子モデルが得られるような分解能での構造解析を行うことができる。また、この方法を用いると、脂質二重層中の構造を得ることができるという利点があり、天然の状態に近い条件での構造解析が可能である。右図にこの方法で得られた光駆動プロトンポンプ、バクテリオロドプシンの原子モデルとそれを取り囲む脂質の構造を示す 1。また、細胞骨格のような繊維状に並ぶ性質をもつタンパク質についても、その繊維が並んで二次元結晶を作る場合があり、実際に微少管を作るチューブリンが二次元結晶からの電子線結晶構造解析により、その原子モデルが報告されている。さらに、繊維状に並んだタンパク質については、らせん対称性を用いて、電子顕微鏡像から三次元構造を再構成することもできる 2。このように電子顕微鏡は、膜タンパク質や繊維状タンパク質に応用できる、高分解能の構造解析を行うこともできる
生体高分子の原子モデルが得られるような分解能での構造解析に用いられる最も一般的な方法としてX線結晶構造解析がある。しかし、X線結晶構造解析を適用するためには三次元結晶が必要である。一方、膜タンパク質などの場合には脂質二重層に局在しているので、天然に二次元結晶と言われる、膜状にタンパク質が規則正しく並ぶ場合があることが知られている。この二次元結晶を用いて電子線結晶構造解析により、X線結晶構造解析と同様に原子モデルが得られるような分解能での構造解析を行うことができる。また、この方法を用いると、脂質二重層中の構造を得ることができるという利点があり、天然の状態に近い条件での構造解析が可能である。右図にこの方法で得られた光駆動プロトンポンプ、バクテリオロドプシンの原子モデルとそれを取り囲む脂質の構造を示す 1。また、細胞骨格のような繊維状に並ぶ性質をもつタンパク質についても、その繊維が並んで二次元結晶を作る場合があり、実際に微少管を作るチューブリンが二次元結晶からの電子線結晶構造解析により、その原子モデルが報告されている。さらに、繊維状に並んだタンパク質については、らせん対称性を用いて、電子顕微鏡像から三次元構造を再構成することもできる 2。このように電子顕微鏡は、膜タンパク質や繊維状タンパク質に応用できる、高分解能の構造解析を行うこともできる
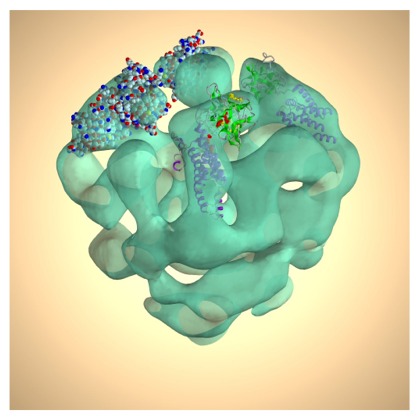 しかし二次元結晶を得るためには、通常、結晶化条件にする必要があり、まったく自由に溶液条件を選ぶことはできない。しかし、単粒子解析という構造解析法を用いることで、生体高分子複合体のような分子量の大きなものについて、その立体構造を電子顕微鏡像から再構成することもできる。この方法を用いれば、ほとんど任意の条件での構造を、二次構造を可視化できる分解能で得ることも可能なので、機能と構造を関係付ける上では、非常に有効な方法と考えることができる。この方法では、溶液中の複合体を急速に凍結することで、薄い非晶質の氷の層に閉じ込められた複合体のいろいろな方向からのクライオ電子顕微鏡像を撮影する。その複合体の位置や向きを合わせて、画像分類を行い、似た画像を平均化することで、ある方向からのS/Nの高い画像を得る。この画像から複合体の三次元配向を決めて、立体構造を再構成する。この方法により、ウィルスなどの対称性高い高分子複合体については、原子モデルが得られるような分解能の構造解析が可能となりつつある。右上図(岩崎憲治先生(大阪大学蛋白質研究所)、宮澤敦夫先生(兵庫県立大学大学院生命理学研究科)提供)にこの方法により得られたイノシトール三リン酸受容体の立体構造と当てはめた原子モデルを示す 3。最近は、コンピュータの計算スピードなどの向上により、より複雑な画像分類が可能となり、異なる状態にあるいくつかの構造を判別してそれぞれの立体構造を得ることもできるので、構造と機能を関係付ける構造解析法として期待されている。また、より複雑な画像解析も可能となり、らせん対称性と単粒子解析の方法を組み合わせることにより、外腕タイニン分子の三次元再構成も行われている 4。
しかし二次元結晶を得るためには、通常、結晶化条件にする必要があり、まったく自由に溶液条件を選ぶことはできない。しかし、単粒子解析という構造解析法を用いることで、生体高分子複合体のような分子量の大きなものについて、その立体構造を電子顕微鏡像から再構成することもできる。この方法を用いれば、ほとんど任意の条件での構造を、二次構造を可視化できる分解能で得ることも可能なので、機能と構造を関係付ける上では、非常に有効な方法と考えることができる。この方法では、溶液中の複合体を急速に凍結することで、薄い非晶質の氷の層に閉じ込められた複合体のいろいろな方向からのクライオ電子顕微鏡像を撮影する。その複合体の位置や向きを合わせて、画像分類を行い、似た画像を平均化することで、ある方向からのS/Nの高い画像を得る。この画像から複合体の三次元配向を決めて、立体構造を再構成する。この方法により、ウィルスなどの対称性高い高分子複合体については、原子モデルが得られるような分解能の構造解析が可能となりつつある。右上図(岩崎憲治先生(大阪大学蛋白質研究所)、宮澤敦夫先生(兵庫県立大学大学院生命理学研究科)提供)にこの方法により得られたイノシトール三リン酸受容体の立体構造と当てはめた原子モデルを示す 3。最近は、コンピュータの計算スピードなどの向上により、より複雑な画像分類が可能となり、異なる状態にあるいくつかの構造を判別してそれぞれの立体構造を得ることもできるので、構造と機能を関係付ける構造解析法として期待されている。また、より複雑な画像解析も可能となり、らせん対称性と単粒子解析の方法を組み合わせることにより、外腕タイニン分子の三次元再構成も行われている 4。
単粒子解析法は同じ形をした複合体が大量に存在することを前提にしているが、細胞レベルでは、生体試料が同じ形をしていることは期待できない。そこで、平均化をせずに立体構造を得る方法として電子線トモグラフィー法が考えられ、最近、クライオ電子顕微鏡像にも応用されるようになってきている。電子線トモグラフィーでは傾斜像シリーズを自動で撮影して、そのいろいろな向きからの像を用いて三次元再構成を行う。得られる分解能は数nm程度であるが、平均化していない構造が得られ、細胞中の複合体などについては、その位置や向きを同定することも可能である。この方法により、光学顕微鏡などで得られた単分子解析を結果と、原子モデルが得られているような立体構造を関係づけられる可能性がある。
以上は、生の生体試料を凍らせて、そのまま見る方法を紹介してきたが、それらの方法では電子線による損傷が問題となり、S/Nの良いデータを得るのが困難である。そこで、試料作製の方法を工夫することで、生体試料の構造をなるべく忠実に再現しながら、電子線損傷に強い試料を作ることが古くから行われてきた。その一つの方法が凍結割断レプリカ法である。急速凍結した試料をそのまま割ることで、観察したい生体膜やその近傍を表面に露出させることができる。そこで、その表面に金属を含んだ炭素を蒸着することで、その表面形状を写し取って、そこから生体試料を溶かして洗うことで、表面の構造をほぼ忠実に再現した導電性のレプリカ膜を得ることができる。生体試料を溶かす前に、抗体などを作用させることで、分子の同定もかなり正確に行うことができる。また、急速凍結後に温度を上げて水を昇華させることで、生体膜近くのより多くの構造が観察できるようになる。また、最近は凍らせた試料から、よりS/Nの良いデータを得るため、電子位相顕微鏡法の開発なども行われている 5。
もちろん、レプリカ法など以外にも、多くの試料作製法が開発されており、例えば生体高分子の立体構造観察には、生体高分子で排除された重原子を観察する負染色法が一般に用いられている。ここでは、そのすべてについて網羅することはできないが、電子顕微鏡の特徴として、このように広い分解能レンジに適用できるいろいろな試料作製法や構造解析法が開発されていることがあげられる。また、現在でもいろいろな開発が積極的に行われており、適用できる対象も増え、分解能も向上してきている。光学顕微鏡の分解能も向上しているが、例えば原子モデルを当てはめるような像は現在まで得られておらず、そのような原子モデルと細胞内での機能とを結びつける装置として、今後、電子顕微鏡が重要な役割を果たすと期待している。
[参考文献]
[1] 光岡 薫, 平井 照久, 生物物理, 39(3), 148-153 (1999)
[2] 難波 啓一, 生物物理, 43(3) 118-123 (2003)
[3] 岩崎 憲治, 宮澤 淳夫, 生物物理, 45(4) 192-197 (2005)
[4] 吉川 雅英, 八木 俊樹, 生物物理, 48(6), 325-329 (2008)
[5] 永山 國昭, 生物物理, 44(6), 281-285 (2004)
産業技術総合研究所バイオメディシナル情報研究センター 光岡 薫
