粘菌
「細胞質分裂の物理的な仕組み」
■背景
細胞分裂は、細胞の増殖に必須のプロセスで、細胞全体の形態や細胞内部の構造がダイナミックに変化します。動物や、細胞性粘菌Dictyostelium discoideumなどのアメーバ細胞の場合は、核が分裂したあと、別れた二つの核の間の細胞膜がくびれ切れることにより、新しい細胞が二つ誕生します(細胞質分裂)。細胞質分裂は、円周状の「たが」のような収縮環とよばれる構造が細胞中央部に構築され(図1)、これが筋肉と同じような機構で収縮することで駆動されると考えられています。実際、馬渕と奥野の先駆的な研究により、筋肉の収縮を駆動するミオシンというタンパク質の働きを阻害すると、ウニの卵の細胞質分裂が阻害されることが示されています(1)。
さて細胞性粘菌は、高等動物細胞と同じようなタンパク質群をもち、同じようなメカニズムで運動したり分裂することが知られていますが、高等動物とは異なり、遺伝子の変異体を作ることが大変容易です。そのため、アメーバ運動や走化性、細胞分裂のメカニズムを分子レベルで解明するための有力な実験系となっています。例えば、1987年には細胞性粘菌のミオシン遺伝子を破壊した「ミオシンナル細胞」が作成され、そうした細胞を懸濁培養したところ、核分裂は正常に起こるものの、細胞質分裂ができないため、巨大な多核体となって死んでしまうことが示され(2)、馬渕と奥野の発見が分子遺伝学的に確認されました。
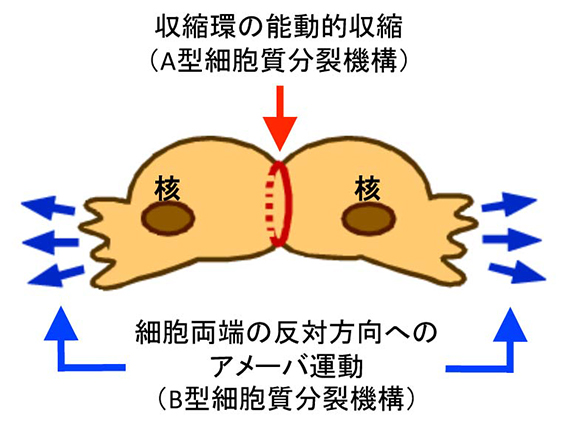
図1。A型細胞質分裂とB型細胞質分裂。

図2.A型細胞質分裂により分裂している野生型細胞(上)と、B型細胞質分裂により分裂しているミオシンナル細胞の位相差顕微鏡像と模式図(下)。黒矢印は力の方向を、白抜き矢印(下)はアメーバ運動の方向を示す。A型細胞質分裂を行っている細胞は、基質(この場合は、細胞が張り付いているカバーガラス)からはずれて球状化する傾向があり、そのため位相差顕微鏡では白く光って見えるが、B型細胞質分裂を行う細胞は平たく基質とよく接着したまま分裂するため黒く見える。顕微鏡写真はともに30秒間隔で撮影。文献4より許可を得て改変複製。
■研究概要
懸濁培養では細胞質分裂ができないミオシンナル細胞ですが、シャーレで培養した時など、硬い基質上では分裂できることは当初からわかっていました(そうでなければ、その細胞株を培養することはできません)。これは、考えてみるとミオシンが細胞質分裂に必須であるという考えと明らかに反する現象なのですが、われわれを含め、当初はこれを疑問視する研究者はほとんどいませんでした。しかし1997年にドイツのグループが(3)、遅れてわれわれがこの矛盾を意識するようになって詳しい解析を始めたところ、硬い基質上では、ミオシンナル細胞も、野生型細胞とほぼ同じような形態変化を経て正常に分裂できることがわかりました(図2)。さらにわれわれは、ミオシンナル細胞の細胞質分裂には、ミオシンとは全く無関係の特定の他のタンパク質が必要であり、二つの核の間が能動的にくびれるのではなく、細胞の両端が反対方向にアメーバ運動することにより、中央部分が受動的にちぎられることを示しました(4)。われわれは、ミオシンに依存した細胞中央部の能動的収縮による分裂をA型細胞質分裂機構、両端のアメーバ運動による受動的引きちぎれをB型細胞質分裂機構とよんでいます。その後、哺乳類の培養細胞もB型細胞質分裂を行うことが明らかとなりました(5)。
なお、Entamoeba invadensという原生動物アメーバでは、細胞質分裂にともなって細胞中央部にくびれは生じるものの、そのくびれがなかなか切れにくいのですが(へその緒がつながったような状態)、周囲の仲間の細胞が近寄っていって物理的に引きちぎってやることが知られています(6)。これは、へその緒のアナロジーから「助産婦現象」とよばれ、走化性に依存しますが、われわれは細胞性粘菌でも同じ現象が起きることを見出しています(7)。
以上のように、細胞性粘菌を用いた分子生物学や細胞生物学的研究から、動物型細胞の細胞質分裂には複数の物理的機構があり、それらが協調することで種々の条件下で確実な細胞分裂が行えるようになっているという描像が浮かび上がってきました。動物体内のほとんどの細胞は、他の細胞や細胞外基質に接着しており、そうした状態でも、従来から考えられてきたようにA型細胞質分裂機構が主なのか、実はB型細胞質分裂機構が主なのかは、未解明のままです。
■科学的・社会的意義 一方、ウニの卵や懸濁培養の細胞性粘菌細胞のように足場のない状態では、A型の細胞質分裂機構が主にならざるを得ません。ヒトの体でこれに対応するのは、受精卵と、ガン細胞です。ガン細胞は一般に基質への接着が弱く、A型細胞質分裂機構に依存することがわかっていますので、A型細胞質分裂は、新たな抗がん治療の標的になる可能性があります。
■参考文献
1. Mabuchi I & Okuno M (1977) The effect of myosin antibody on the division of starfish blastomeres. J. Cell Biol. 74:251-263.
2. De Lozanne A & Spudich JA (1987) Disruption of the Dictyostelium myosin heavy chain gene by homologous recombination. Science 236:1086-1091.
3. Neujahr R, Heizer C, & Gerisch G (1997) Myosin II-independent processes in mitotic cells of Dictyostelium discoideum: redistribution of the nuclei, re-arrangement of the actin system, and formation of the cleavage furrow. J. Cell Sci. 110:123-137.
4. Nagasaki A, de Hostos E, & Uyeda TQP (2002) Genetic and morphological evidence for two parallel pathways of cell-cycle-coupled cytokinesis in Dictyostelium. J. Cell Sci. 115:2241-2251.
5. Kanada M, Nagasaki A, & Uyeda TQP (2005) Adhesion-dependent and contractile-independent equatorial furrowing during cytokinesis in mammalian cells. Mol. Biol. Cell 16:3865-3872.
6. Biron D, Libros P, Sagi D, Mirelman D, & Moses E (2001) Asexual reproduction: 'midwives' assist dividing amoebae. Nature 410:430.
7. Nagasaki A & Uyeda TQP (2008) Chemotaxis-mediated scission contributes to efficient cytokinesis in Dictyostelium. Cell Motil Cytoskeleton 65:896-903.
■良く使用する材料・機器 共焦点レーザー顕微鏡システム (横河電機株式会社)
H27年度分野別専門委員
産業技術総合研究所
上田太郎(うえだたろう)
https://www.qp.phys.waseda.ac.jp/index.html
「粘菌細胞に学ぶ自発性・走性の階層構造」
■背景 細胞の自発性は,粘菌細胞を含めて様々な細胞に見られ,生物の特徴のひとつと考えることができます.例えば,細胞性粘菌Dictyostelium discoideumのアメーバ様細胞は,環境に刺激が無くても自発的に勝手にふらふらと動きまわる性質(自発性)を示し,これにより環境をランダムに探索することが知られています.刺激(例えば化学物質,電場などの空間勾配)があると,ランダムにゆらぐ自発運動が特定の方向へとバイアスされ,方向性のある運動(走性運動)を行ないます(図1).走性(例えば,走化性,走電性など)は,単細胞生物の環境探索だけでなく,多細胞生物の免疫応答や神経回路形成にも重要な細胞機能として知られています.こうした細胞の行動を特徴づける自発性と走性の背後にはどのような分子メカニズムが働いているのでしょうか?
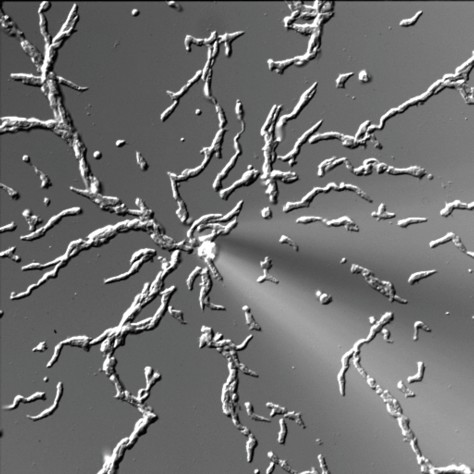
図1 細胞性粘菌Dictyostelium discoideumのアメーバ細胞が示す走化性応答.細いガラス管の中にcAMPという化学物質の水溶液が入れてある.cAMPはガラス管の先端から拡散して濃度勾配を形成する.個々の粘菌細胞は,その濃度勾配を認識し,濃度の高い方へ向かって運動する(走化性).電場を与えられたときには,マイナス極に向かって運動する(走電性,文献4).こうした刺激がないときにも粘菌細胞は運動するが,その方向はランダムである.
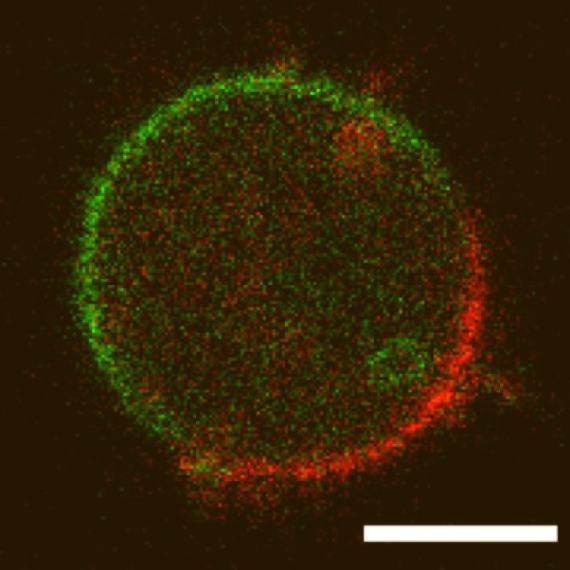
図2 細胞内自己組織化反応によって形成された自発運動シグナル.イノシトールリン脂質の一種であるPIP3(緑)とPIP3分解酵素のPTEN(赤)の細胞内局在をイメージングした.これらの分子は細胞膜に沿って相互排他的に局在している.緑の所から細胞の先端部ができ,赤い所は細胞の後ろになって,細胞は運動する(この写真では,ある薬剤の処理により細胞が動けない状態になっている).走化性の刺激があるとPIP3(緑)が刺激の多い方に局在する.
■研究概要 細胞性粘菌の自発・走性運動には,フォスファチジルイノシトールリン脂質の細胞内分布を制御するシグナル伝達系が関与しています.このシグナル伝達系のはたらきを顕微鏡で調べたところ,細胞の前と後ろを決めるシグナルが自己組織化反応によって自発的に生成され,そのシグナルによって細胞の自発・走性運動が制御されることが明らかになりました(図2,文献1).また,実験結果に基づいて,自発・走性運動を記述する数理モデルの構築に成功しました(文献2,3).こうした研究から,細胞が自発的にふらふらと動きまわる性質を持つことは,細胞にとって無駄な事をしている訳ではなく,複雑に変動する環境に細胞がうまく適応するのに役立っていることが分かってきました(無用の用).今後は,細胞内の分子を1分子レベルで観察できる顕微鏡を用いて,細胞の自発性・走性を生み出す階層構造を1分子粒度の解像度で理解したいと考えています.
■科学的・社会的意義 生物の特徴の一つである「自発性」がどのような分子メカニズムで生み出されるのかを理解するのに役立つと共に,ゆらぎを利用した生物らしい探索アルゴリズムを工学的に利用する試みも行なわれています.
■参考文献
1)Arai, Y., et al. (2010) “Self-organization of the phosphatidylinositol lipids signaling for random cell migration.” Proc. Natl. Acad. Sci. USA. 107: 12399-12404.
2)Takagi, H., et al. (2008). “Functional analysis of spontaneous cell movement under different physiological conditions.” PLoS ONE 3: e2648.
3)Nishimura, S. I., et al. (2012). “Non-Brownian dynamics and strategy of amoeboid cell locomotion.” Physical Review E. 85, 041909.
4)Sato, M. J., et al. (2010) “Switching direction in electric-signal-induced cell migration by cyclic guanosine monophosphate and phosphatidylinositol signaling.” Proc. Natl. Acad. Sci. USA. 106: 6667-6672.
■良く使用する材料・機器
1) 共焦点レーザー顕微鏡システムA1 (株式会社ニコン)
2) 自作の細胞内1分子イメージング装置(顕微鏡本体はニコン製ECLIPSE Ti)
3) 背面照射型EMCCDカメラ ImagEM (浜松ホトニクス株式会社)
4) 超高感度EMCCDカメラiXON (アンドール社製)
H24年度分野別専門委員
大阪大学大学院・理学研究科
上田昌宏 (うえだまさひろ)
https://www.bio.sci.osaka-u.ac.jp/bio_web/lab_page/ueda/index.html
