チャネル
「イオンチャネルの活性を捉える」
■背景
イオンチャネルは、細胞膜で細胞内外のイオンの透過を制御しているタンパク質であり、生体内で種々の重要な機能を担っています。ヒトでは疼痛、てんかん、心疾患などの様々な疾患に関わり、創薬の標的分子として注目されているほか、殺虫剤の作用分子としても重要視されています。イオンチャネルに対する治療薬や農薬を創製するには、多数の候補薬剤のチャネルへの作用を効率的に調べる必要があります。
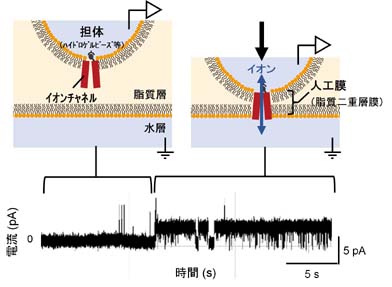
図1 開発した高効率なイオンチャネル活性測定法。イオンチャネルを化学修飾で固定した親水性の担体(ハイドロゲルビーズなど)を用いる。担体と脂質層の界面に生じる脂質一重層膜と、測定水溶液層と脂質層の界面に自発的に生じる一重層膜を能動的に接触させることで、イオンチャネルが組み込まれた人工膜(脂質二重層膜)を作製し、チャネルを通るイオンの流れを電流として迅速に捉える。

図2 開発した自動チャネル電流測定装置
■研究概要
薬剤のイオンチャネル活性への効果を調べるため、細胞膜を模倣した人工膜を用いて、高効率・高精度なチャネル活性測定法・装置を開発しています。これまでに、イオンチャネルを固定した担体を用いることで、イオンチャネルを含む人工膜を簡便に作製する方法を開発し、測定効率を従来法より100倍以上高めることに成功しています(図1)。この方法では、イオンチャネルを透過するイオンの流れを電気的に計測しているため、高精度な測定が可能です。さらに、近年、この方法を基に自動チャネル電流測定装置の試作機を作製しており、イオンチャネルを標的とする医薬品・農薬の評価装置としての展開を進めています(図2)。
■科学的・社会的意義
本研究は、イオンチャネルが原因で引き起こされる難病の治療薬や、より効果が高く安全な農薬への開発に貢献することが期待されます。また、種々のイオンチャネルが持つ独自の特性を生かせば、GABAやアセチルコリンなどの神経伝達物質や、コカインなどの麻薬を捉えるセンサーとしての発展も見込まれます。
■参考文献
1)Hirano, M., Tomita, M., et al. (2021). "Development of an automated system to measure ion channel currents using a surface-modified gold probe." Scientific Reports 11(1): 17934.
2)Okuno, D., Hirano, M., et al. (2018). "A gold nano-electrode for single ion channel recordings." Nanoscale 10(8): 4036-4040.
■良く使用する材料・機器
1) パッチクランプアンプ (日本光電工業株式会社)
2) データ取得装置 (Molecular Devices)
3) 実験試薬 (東京化成工業株式会社、富士フイルム 和光純薬株式会社)
2023年度分野別専門委員
岡山大学学術研究院ヘルスシステム統合科学学域
平野美奈子 (ひらのみなこ)
http://www.cc.okayama-u.ac.jp/single_molecule/index.html
「イオンチャネルによるイオン透過のしくみを知る」
■背景
細胞は疎水性の細胞膜で外界との仕切りを作って、細胞内を一定の環境に保っています。細胞内外の情報のやり取りは、膜蛋白質と呼ばれる細胞膜中に存在する蛋白質を介して行われます。膜蛋白質は様々な種類が存在し、イオンを透過することで細胞内に情報を伝える役目を担っている膜蛋白質が「イオンチャネル」と呼ばれます。イオンチャネルは環境によりイオンを透過する開いた構造と透過しない閉じた構造をとり、イオンの透過を制御しています(図1、文献1)。さて、イオンチャネルはどのように環境の変化を捉え、構造を変えてイオンの透過を制御しているのでしょうか?
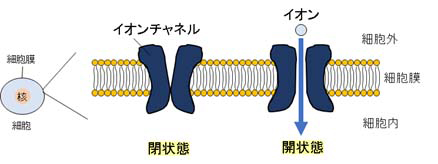
図1. イオンチャネルによるイオン透過の模式図

図2. イオンチャネル1分子を透過するイオン電流
■研究概要 イオンチャネルが環境に応じてイオン透過を制御するしくみを調べるため、イオンチャネルの構造と機能(イオン透過)を調べ、それらの相関を明らかにしようとする研究が行われています。近年の構造解析法の進展により、様々なイオンチャネルの構造が明らかになり、構造に関する理解は飛躍的に深まっていっています。また、イオンチャネルを通るイオンは電流として電気的に捉えることが可能であり、1分子レベルでの詳細な計測も可能です(図2)。これらの解析手法に遺伝子工学的手法や蛍光計測、シミュレーションなどの手法を組み合わせ、それぞれのイオンチャネルの開閉モデルが提唱されています。我々は、あるカリウムチャネルの結晶構造の情報をもとに遺伝子工学的手法で変異体を作製し、イオン電流を調べることで刺激感知部位を同定しました(文献2)。そして、刺激感知部位を環境感受性の蛍光色素で標識し、活性が異なる条件下で蛍光強度を測定することで、開状態と閉状態の構造状態の違いを明らかにしました(文献3)。
■科学的・社会的意義 イオンチャネルは細胞内のイオン環境を制御する生理的に重要な蛋白質であるため、イオンチャネルの異常は重篤な疾患を引き起こします。イオンチャネルの働く仕組みを明らかにすることは、疾患の原因解明や治療に大きく貢献します。また、イオンチャネルは特有の生体小分子を感知する特性や、毒により機能が阻害される特性を持っています。この特性を利用して高感度なバイオセンサーを創る試みもなされています。
■参考文献
1)Hille, B. (2001). “Ion Channels of Excitable Membranes.” Sinauer Associates, Inc., Sunderland, MA.
2)Hirano, M., Onishi, Y., Yanagida, T., Ide, T. (2011) “Role of the KcsA channel cytoplasmic domain in pH-dependent gating” Biophys. J., 101(9), 2157-2162.
3) Hirano, M, Takeuchi, Y., Aoki, T., Yanagida, T., Ide, T. (2010) “Rearrangements in the KcsA cytoplasmic domain underlie its gaiting” J.Biol. Chem., 285(6), 3777-3783.
■良く使用する材料・機器
1)チャネル電流測定装置(Molecular Devices)
2)実験試薬(和光純薬株式会社)
3)倒立顕微鏡(株式会社オリンパス)
H29年度分野別専門委員
光産業創成大学院大学・光バイオ分野
平野美奈子 (ひらのみなこ)
https://www.gpi.ac.jp/research/bio/professor-16/
「膜輸送のダイナミクスに迫る」
■背景
細胞膜はたった1つの水分子も通さない疎水性の構造を作っていますが、そこに埋め込まれたチャネルやトランスポーター(膜輸送体)が、物質の輸送に働き、細胞内の状態を、外界とは異なる、一定の状態に保っています。
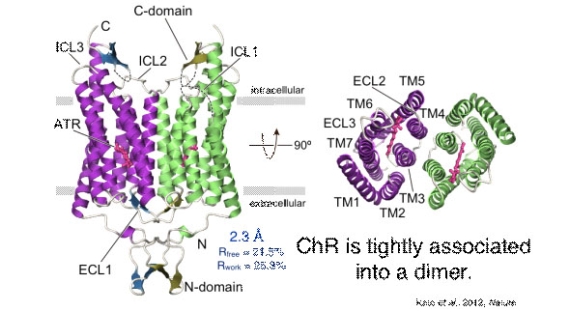
図1 光駆動カチオンチャネルの結晶構造
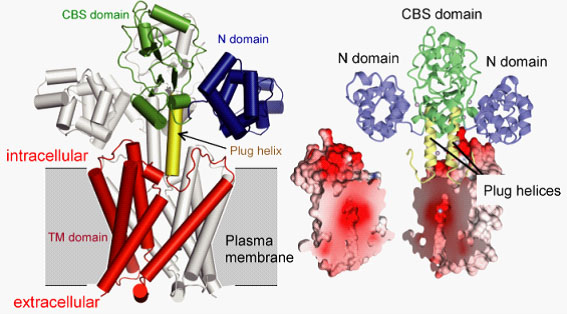
図2 細胞内マグネシウム濃度に応じて開閉するマグネシウムチャネルMgtEの結晶構造。
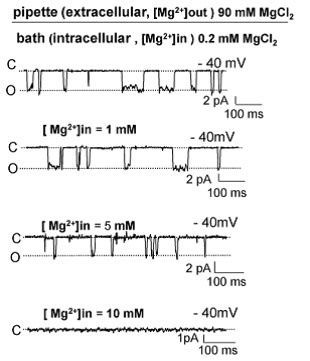
図3 細胞内マグネシウム濃度に応じて開閉するMgtEのチャネル活性。
■研究概要 チャネルやトランスポーターが、どのようなエネルギーを使って輸送を駆動するのか、輸送基質をどのように厳密に識別しているのか、細胞内の環境に応じてどのように輸送を制御しているのか、と言った問題を明らかにするために、X線結晶構造解析により膜輸送体の静止構造(スナップショット)を決定し(図1、2)、分子動力学シミュレーションを用いて動的な構造を明らかにし、パッチクランプ(図3)や蛍光分光法を用いて相補的な機能解析を行うことで、膜輸送体の分子機構を解明しています。
■科学的・社会的意義 本研究は、膜輸送体のダイナミックな分子機構を原子分解能で明らかにし、これに基づいて、膜輸送体の異常な働きにより惹起される数多くの疾患の予防・治療に貢献することが期待されます。
■参考文献
1)“Crystal structure of the channelrhodopsin light-gated cation channel” H. E. Kato, F. Zhang, O. Yizhar, C. Ramakrishnan, T. Nishizawa, K. Hirata, J. Ito, Y. Aita, T. Tsukazaki, S. Hayashi, P. Hegemann, A. D. Maturana, R. Ishitani, K. Deisseroth and O. Nureki
Nature 482, 369-374 (2012).
2)“Structure and function of a membrane component SecDF that enhances protein export” T. Tsukazaki, H. Mori, Y. Echizen, R. Ishitani, S. Fukai, T. Tanaka, A. Perederina, D. G. Vassylyev, T. Kohno, A. D. Maturana, K. Ito and O. Nureki Nature 474, 235-238 (2011).
3)“Structure and function of a membrane component SecDF that enhances protein export” T. Tsukazaki, H. Mori, Y. Echizen, R. Ishitani, S. Fukai, T. Tanaka, A. Perederina, D. G. Vassylyev, T. Kohno, A. D. Maturana, K. Ito and O. Nureki Nature 474, 235-238 (2011).
4)“Mg2+-dependent gating of bacterial MgtE channel underlies Mg2+ homeostasis” M. Hattori, N. Iwase, N. Furuya, Y. Tanaka, T. Tsukazaki, R. Ishitani, M. E. Maguire, K. Ito, A. Maturana and O. Nureki EMBO J 28, 3602-3612 (2009).
5)“Conformational transition of Sec machinery inferred from bacterial SecYE structures” T. Tsukazaki, H. Mori, S. Fukai, R. Ishitani, T. Mori, N. Dohmae, A. Perederina, Y. Sugita, D. G. Vassylyev, K. Ito and O. Nureki Nature 455, 988-991 (2008).
6)“Mg2+-sensing mechanism of Mg2+ transporter MgtE probed by molecular dynamics study” R. Ishitani, Y. Sugita, N. Dohmae, N. Furuya, M. Hattori, and O. Nureki
Proc. Natl. Acad. USA., 105, 15393-15398 (2008).
7)“Crystal structure of the MgtE Mg2+ transporter” M Hattori, Y. Tanaka, S. Fukai, R. Ishitani, O. Nureki Nature 448, 1072-1075 (2007).
■良く使用する材料・機器
1) SPring-8シンクロトロン放射光
2) 京コンピューター
3) パッチクランプ
 H24年度分野別専門委員
H24年度分野別専門委員
東京大学大学院理学系研究科生物化学専攻
濡木 理 (ぬれき おさむ)
https://www.nurekilab.net/
